
【题目】下列说法中,正确的是( )
A.氧化剂本身被还原,生成氧化产物
B.氧化剂是在反应中得到电子(或电子对偏向)的物质
C.还原剂在反应时所含元素的化合价降低
D.在一个反应中,氧化剂和还原剂不可能是同一物质
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关滴定操作的顺序正确的是:①用标准溶液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤洗涤( )
A. ③⑤①②④ B. ⑤①②③④ C. ⑤②③①④ D. ②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由X、Y和Z合成缓释药物M,下列说法不正确的是
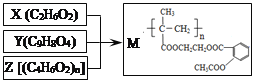
A. M在体内能缓慢发生水解反应
B. X可以由乙烯通过加成反应和取代反应制备
C. 1mol Y与NaOH溶液反应,最多能消耗3mol NaOH
D. Z由加聚反应制得,其单体的结构简式是CH3CH=CHCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化锂是一种高效的水汽吸收剂,其一种绿色工业合成工艺如下(部分操作和条件已略去)。
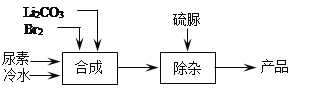
已知:碳酸锂微溶于水,水溶液显碱性。
(1)Br2的电子式是______。
(2)合成过程中发生的反应如下,请写出ii反应的化学方程式并将iii补充完整。
ⅰ. Br2 +H2O![]() HBr +HBrO;
HBr +HBrO;
ⅱ._____;
ⅲ. 3LiBrO + CO(NH2)2(尿素)=3LiBr+_____。
(3)LiBrO3是生产过程中的副产物。
①用化学方程式表示生成改副产物的原因:______。
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再______,直到尿素完全转化。
③常用硫脲除去LiBrO3,反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 ,选用硫脲除杂的优点是_______;缺点是引入新杂质且溶液酸性增强,为解决该问题需要加入的试剂是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因水解反应而不能大量共存的是
A. H+ 、 Cl- 、 OH- 、 Na+
B. Fe3+ 、NO3- 、S2-、 Na+
C. Ba2+ 、Al3+ 、 K+ 、 〔Al(OH)4 〕-
D. NH4+ 、CO32-、 K+ 、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
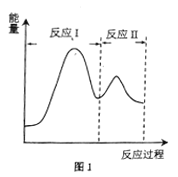
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为S + KNO3 + C→K2S + N2↑+ CO2↑,根据该反应回答下列问题:
(1)请写出配平后的化学方程式_____________________________________________。
(2)写出该反应的氧化剂_____________、还原剂______________。
(3)用双线桥法标出该反应电子转移的方向和数目____________________________。
(4)若该反应有48克硫完全反应,则转移电子的物质的量为____________,生成氧化产物的质量为__________。
(5)若该反应转移了0.6mol电子,则生成的气体在标准状况下的体积为___________。所得气体的平均相对分子质量为________________。
(6)若生成的氧化产物的质量比还原产物的质量少12克,则转移电子的物质的量为____________,参加反应的碳的质量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 从1L1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 制备0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
C. 0.5L 2mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示:
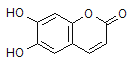
下列叙述正确的是
A. M的相对分子质量为180
B. 1mol M最多能与2mol Br2发生反应
C. M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4
D. 1mol M与足量NaHCO3反应能生成2molCO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com