
【题目】下列有关物质性质与用途具有对应关系的是
A.热的碳酸钠溶液碱性较强,可用于洗涤油污
B.液氨具有还原性,可用作制冷剂
C.石墨具有导电性,可用于制铅笔芯
D.浓硫酸具有强氧化性,可用于干燥H2
科目:高中化学 来源: 题型:
【题目】常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7).
(1)用离子方程式表示该溶液中存在的三个平衡体系______________、_______________、___________________
(2)溶液中各离子的物质的量浓度由大到小顺序为_____________________________________________________
(3)溶液中粒子中浓度为0.1mol/L的是________________,浓度为0.05mol/L的是____________________
(4)物质的量之和为0.lmol的两种粒子是______________与__________
(5)CH3COO-和OH-的物质的量之和比H+多________mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
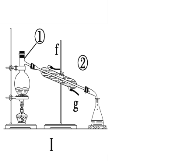
(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
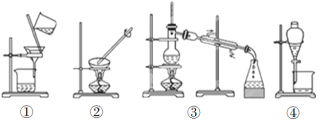
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验
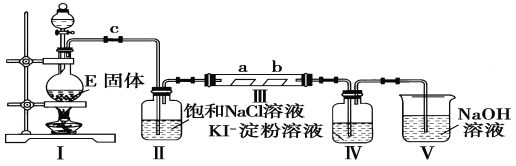
(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式为_______________。
(2)装置Ⅱ的作用是____________________________________。
(3)实验过程中,装置Ⅳ中的实验现象为_________________________;发生反应的化学方程式为_______________________________。
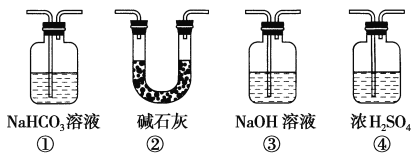
(4)实验结束后,该组同学在装置Ⅲ中(a是干燥的品红试纸,b是潮湿的品红试纸)观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置_______与_____________之间添加下图中的_____________装置(填序号),该装置的作用是____________。
(5)装置V的目的是防止尾气污染空气,写出装置V中发生反应的化学方程式:_________________。
(6)将8.7 g MnO2与含HCl 14.6 g的浓盐酸共热制Cl2,甲同学认为可制得Cl2 7.1 g,乙同学认为制得Cl2的质量小于7.1 g,你认为__________(填“甲”或“乙”)同学正确,原因是 ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)氨和肼(N2H4)是两种最常见的氮氢化物。
己知:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为_________,该反应的化学平衡常数K=____(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为_________,该反应的化学平衡常数K=____(用K1、K2表示)。
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是____(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆 D.容器中混合气体的平均摩尔质量不变
②图1为容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)= ____,平衡时NO的转化率为____。

(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式_________。用离子方程式表示吸收池中除去NO的原理__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )
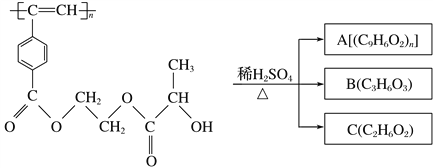
M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸年产量的高低可衡量一个国家化工生产水平发展的高低,SO2转化为SO3是制备硫酸中的关键性反应,也是一个可逆反应。
(1)NO可作为SO2与O2间反应的催化剂,催化机理如下:
①2NO(g)+O2(g)![]() 2NO2(g)ΔH1=-113kJ/mol
2NO2(g)ΔH1=-113kJ/mol
②SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH2
SO3(g)+NO(g) ΔH2
总反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
(2)一定温度下,向容积为2L的恒容密闭容器中充入2molSO2、2mo1O2测得容器中压强的变化如下表所示(SO3为气体):
反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/MPa | 16.0a | 14.7a | 13.7a | 13.0a | 12.5a | 12.4a | 12.4a |
①0~10min内,υ(SO2)=_________
②该温度下的平衡常数K=__(结果保留一位小数)。
③反应达到平衡后,再向容器中同时充入均为0.2mol的三种气体后,υ(正)、υ(逆)的关系是___
(3)一定温度下,向某密闭容器中通入一定量的二氧化硫和氧气的混合气体并使之反应,反应过程中SO2、O2、SO3物质的量变化如下图所示:
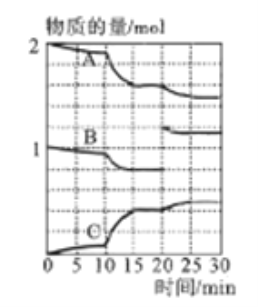
①A、B、C三条曲线中表示SO2物质的量的变化的是__,若在15~20min、25~30min两个时间段内容器容积不变,则在某一时刻SO3的分解速率较大的时间段是_______。
②10~15min内反应速率发生了明显变化,其可以的原因有__________
(4)常温下,用NaOH溶液吸收SO2既可消除SO2造成的大气污染,也可获得重要的化工产品,若某吸收液中c(HSO3-):c(SO32-)=1:100,则所得溶液的pH=______(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com