
����Ŀ�������������ڹ�ũҵ�����ж�����ҪӦ�á�
��1�������£�N2H4������������ĵ��⻯�
��֪��4NH3(g)��3O2(g) ![]() 2N2(g)��6H2O(g) ��H1=��541.8kJ/mol����ѧƽ�ⳣ��ΪK1��N2H4(g)��O2(g)
2N2(g)��6H2O(g) ��H1=��541.8kJ/mol����ѧƽ�ⳣ��ΪK1��N2H4(g)��O2(g) ![]() N2(g)��2H2O(g) ��H2=��534kJ/mol����ѧƽ�ⳣ��ΪK2������NH3��O2��ȡN2H4���Ȼ�ѧ����ʽΪ_________���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=____����K1��K2��ʾ����
N2(g)��2H2O(g) ��H2=��534kJ/mol����ѧƽ�ⳣ��ΪK2������NH3��O2��ȡN2H4���Ȼ�ѧ����ʽΪ_________���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=____����K1��K2��ʾ����
��2������2NO(g)��2CO(g) ![]() N2(g)��2CO2(g)����һ���¶��£���1L�ĺ����ܱ������г���0.1molNO��0.3molCO����Ӧ��ʼ���С�
N2(g)��2CO2(g)����һ���¶��£���1L�ĺ����ܱ������г���0.1molNO��0.3molCO����Ӧ��ʼ���С�
��������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����____������ĸ���ţ���
A��c(CO)=c(CO2) B�������л��������ܶȲ���
C��v(N2)��=2v(NO)�� D�������л�������ƽ��Ħ����������
��ͼ1Ϊ�����ڵ�ѹǿ��P������ʼѹǿ��P0���ı�ֵ��P/P0����ʱ�䣨t���ı仯���ߡ�0��5min�ڣ��÷�Ӧ��ƽ����Ӧ����v(N2)= ____��ƽ��ʱNO��ת����Ϊ____��

��3��ʹ�ü�ӵ绯ѧ���ɴ���ȼú�����е�NO��װ����ͼ2��ʾ����֪���ص�����������Һ��pH��4��7֮�䣬д�������ĵ缫��Ӧʽ_________�������ӷ���ʽ��ʾ���ճ��г�ȥNO��ԭ��__________________��
���𰸡� 4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=��526.2kJ/mol ![]() D 0.006 mol��L��1��min��1 80% 2HSO3����2e����2H��=S2O42����2H2O 2NO��2S2O42����2H2O=N2��4HSO3��
D 0.006 mol��L��1��min��1 80% 2HSO3����2e����2H��=S2O42����2H2O 2NO��2S2O42����2H2O=N2��4HSO3��
��������(1)��4NH3(g)��3O2(g) ![]() 2N2(g)��6H2O(g) ��H1=��541.8kJ/mol����ѧƽ�ⳣ��ΪK1����N2H4(g)��O2(g)
2N2(g)��6H2O(g) ��H1=��541.8kJ/mol����ѧƽ�ⳣ��ΪK1����N2H4(g)��O2(g) ![]() N2(g)��2H2O(g) ��H2=��534kJ/mol����ѧƽ�ⳣ��ΪK2�����ݸ�˹���ɣ�����-����2�ã�4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=(��541.8kJ/mol)-(��534kJ/mol)��2=��526.2kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=
N2(g)��2H2O(g) ��H2=��534kJ/mol����ѧƽ�ⳣ��ΪK2�����ݸ�˹���ɣ�����-����2�ã�4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=(��541.8kJ/mol)-(��534kJ/mol)��2=��526.2kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() ���ʴ�Ϊ��4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=��526.2kJ/mol��
���ʴ�Ϊ��4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=��526.2kJ/mol�� ![]() ��
��
(2)����2NO(g)��2CO(g) ![]() N2(g)��2CO2(g)����һ���¶��£���1L�ĺ����ܱ������г���0.1molNO��0.3molCO����Ӧ��ʼ���С�
N2(g)��2CO2(g)����һ���¶��£���1L�ĺ����ܱ������г���0.1molNO��0.3molCO����Ӧ��ʼ���С�
��A��c(CO)=c(CO2)������ʾŨ�ȱ仯�������ж��Ƿ�Ϊƽ��״̬����A����B����Ӧ��������������䣬������䣬�����л��������ܶ�ʼ�ղ��䣬�����ж��Ƿ�Ϊƽ��״̬����B����C��v(N2)��=2v(NO)����ʾ��Ӧ����2v(N2)��=v(NO)�����ű�ʾ���淴Ӧ������ȣ���C����D���÷�Ӧ������������ʵ��������仯�ķ�Ӧ�������л�������ƽ��Ħ����������ʱ��ʾ��������ʵ������䣬 ˵����ƽ��״̬����D��ȷ����ѡD��
�����������ڵ�ѹǿ(P)����ʼѹǿ(P0)�ı�ֵ(P/P0)��ʱ��(t)�ı仯���ߣ�0��5min�ڣ� ![]() =0.925�����ݰ���٤�����ɼ������ۣ�
=0.925�����ݰ���٤�����ɼ������ۣ� ![]() =0.925��ƽ��ʱ
=0.925��ƽ��ʱ![]() =0.90��
=0.90��
2NO(g)�� 2CO(g) ![]() N2(g)��2CO2(g)
N2(g)��2CO2(g)
��ʼ(mol) 0.1 0.3 0 0
��Ӧ 2x 2x x 2x
5min��ƽ��
5minʱ�� ![]() =0.925�����x=0.03mol��v(N2)=
=0.925�����x=0.03mol��v(N2)= 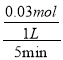 = 0.006mol��L��1��min��1��ƽ��ʱ��
= 0.006mol��L��1��min��1��ƽ��ʱ�� ![]() =0.90�����x=0.04mol��NO��ת����=
=0.90�����x=0.04mol��NO��ת����=![]() ��100%=80%���ʴ�Ϊ��0.006 mol��L��1��min��1��80%��
��100%=80%���ʴ�Ϊ��0.006 mol��L��1��min��1��80%��
(3)����������ԭ��Ӧ����������������ӣ��õ��ӣ����������������ӣ��缫��ӦʽΪ��2HSO3-+2e-+2H+�TS2O42-+2H2O����������������һ����������������ԭ��Ӧ�����ɵ��������ӷ�Ӧ����ʽΪ��2NO+2S2O42-+2H2O�TN2+4HSO3-���ʴ�Ϊ��2HSO3-+2H++2e-=S2O42-+2H2O��2NO+2S2O42-+2H2O=N2+4HSO3-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��뷽������������( )
A. ��ʯ���еõ����ͣ���������ķ���
B. ��ȡ��ˮ�е��壬���ü����Ҵ���ȡ�ķ���
C. ֻ������ɳ�Ĵ��Σ���ͨ���ܽ⡢���ˡ��ᾧ�ķ����ᴿ
D. ��FeCl2��Һ�е�����FeCl3�����ü���������м���˵ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��M��NΪԭ������������������ֶ�����Ԫ�أ������£�����Ԫ�صij�������������Ϊ���壬����Ϊ���塣X��M��W��N�ֱ�ͬ���壬�����ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ���X����Y��Z��W�ֱ��γɵ�������ȵ����ַ��ӣ�Z��W������������֮����M�ĺ������������ȡ��Իش��������⣺
(1)NԪ�������ڱ��е�λ��Ϊ_____________________��Y�ļ��⻯����ȶ���________(����>����<����������)W�ļ��⻯����ȶ��ԡ�
(2)X��Z�γɵĺ�18���ӵĻ�����ĵ���ʽΪ________________________��
(3)��X��Z��W��N����Ԫ����ɵ�һ�����ӻ�����A����֪A���������ᷴӦ����������ˮ��Ӧ��д��A���������ᷴӦ�����ӷ���ʽ___________________________________________��
(4)X��W��ɵĻ������У��Ⱥ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ�����________(�ѧʽ)���˻�����ɽ����Թ�ҵ��ˮ�е�CN������������̼���κͰ�������Ӧ�����ӷ���ʽΪ________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊ�����ӳɷ�Ӧ����������( )
A����ϩʹ����KMnO4��Һ��ɫ
B����ͨ����ˮ�У���ˮ��ӽ���ɫ
C����ϩʹ������Ȼ�̼��Һ��ɫ
D��������������ϣ�����һ��ʱ������ɫ��ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ѡ����ʵ�ͼ������ĸ��գ�

��1����������������п��a��b�ֱ���������ϡ�����У�ͬʱ��a�м���������CuSO4��Һ������H2�����V(L)��ʱ��t(min)�Ĺ�ϵ��ͼ����_______��
��2������1���е�CuSO4��Һ�ij�CH3COONa��Һ�������������䣬��ͼ����_______��
��.Na2FeO4��һ�ּ���ɱ��������������������ˮ�ĸ�Чˮ�������������Ʒ�����ͼ��ʾ���������У������������������Y��������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ�Գ��塣�������ϵ�֪�������������(FeO42-)����Һ�г��Ϻ�ɫ��

��3���������У�X������Һ��pH______(�������С�����䡱)��
��4���������У�Y�������ĵ缫��ӦΪ___________��_____________��
��5������X���ռ���672 mL���壬��Y���ռ���168 mL����(��������Ϊ��״��ʱ�������)����Y�缫(���缫)��������__________g��
��6���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ2K2FeO4��3Zn===Fe2O3��ZnO��2K2ZnO2���õ�������ĵ缫��ӦʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͨ����һ���ִ�����ͨ���ֶΣ�������ά����Ҫԭ����
A. Na2CO3 B. CaO C. CaCO3 D. SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.�ڼ�������Һ�зֱ���뱥��Na2SO4��CuSO4��Һ��������������������
B.˾ĸ�춦����Զ���װ塢�л�������ԭ�������ںϽ�
C.������ά��̼��ά�����ά�������л��߷��Ӳ���
D.ʯ�������ȷֽ�����˿���ʹ���Ը��������Һ��ɫ��ϩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ҩ�ı�ը��ӦΪ��2KNO3+3C+S=A+N2��+3CO2��(����ƽ)
��1����S���⣬��������Ԫ�صĵ縺�ԴӴ�С����Ϊ____________________��
��2�����������У�A�ĵ���ʽΪ____________�������Թ��ۼ��ķ��ӵ�����ԭ�ӹ���ӻ�����Ϊ________��
��3����֪CN-��N2�ṹ���ƣ�����HCN�����ЦҼ���м���Ŀ֮��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�������;�������У�������ǣ� ��
A.��������ұ��ijЩ�۵�ϸߵĽ���
B.Na2O2������Ư��
C.��ʯ�ҿ����ڸ���CO2��NH3������
D.NaClO������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com