
【题目】下列化学过程中,涉及氧化还原反应的是( )
A.实验室制取氧气
B.萃取碘水中的碘
C.粗盐提纯
D.用海水制取蒸馏水
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠又称硫化碱,为无色、易溶于水和热乙醇的固体,常用于制造硫代硫酸钠、多硫化钠、硫化染料等。实验室中用工业硫化钠(因含重金属硫化物和煤粉等而呈褐色)、纯碱等物质制备硫代硫酸钠晶体(Na2S2O3·5H2O)的原理如下:Na2CO3+SO2=Na2SO3+CO2 S+ Na2SO3![]() Na2S2O3。回答下列问题:
Na2S2O3。回答下列问题:
(1)工业硫化钠的纯化
将18g工业硫化钠加入烧瓶中,再加入150mL95%的乙醇溶液和8mL水。用如图所示装置进行沸水浴加热,并回流40min,趁热过滤,冷却、搅拌、结晶、倾析,除去上层母液;最后用95%的乙醇溶液洗涤,烘干,得到Na2S·9H2O晶体。图中仪器a的名称是_______,该过程中回流40min的目的是_______________________________。
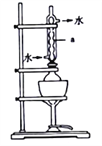
(2)硫代硫酸钠的制备
称取纯化后的Na2S·9H2O晶体14.4g和mgNa2CO3,混合后置于锥形瓶中,加入150mL蒸馏水,微热后按图所示组装仪器;然后,打开分液漏斗的活塞和螺旋夹6,并适当调节该螺旋夹,向锥形瓶中通入SO2气体,当溶液呈中性时,停止通入SO2气体,对反应后落液进行后续处理,即可制得硫代硫酸钠(Na2S2O3·5H2O)。
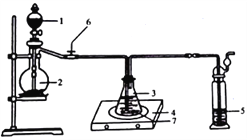
①适当调节螺旋夹6的目的是_______________________________________;
②实验过程中,通入SO2一段时间后,溶液中会生成大量淡黄色沉淀,然后又变澄清。生成淡黄色沉淀的化学方程式为____________________________________。若通入SO2气体时间过长,会降低硫代硫酸钠的产率,原因是_______________________。
③为提高产品纯度,节约原料,m=____g;
④反应结束后,需对溶液进行后续处理,得到硫代硫酸钠晶体(Na2S2O3·5H2O),其操作是蒸发浓缩,冷却结晶、过滤、_____、烘干。称量所得产品,质量为ng,则Na2S2O3·5H2O的产率为_____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对物质的空间结构的下列说法不正确的是
A. 具有4原子共线的可能含碳碳三键
B. 具有4原子共面一定含醛基
C. 具有6原子共面的可能含碳碳双键
D. 具有12原子共面的可能含苯环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列是A、B、C、D、E五种短周期元素的相关数据:
A | B | C | D | E | |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是________。
A.![]() B.CH4
B.CH4
C.CH2==CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键:____________。
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是______(化学式),理由是____。
(4)B、D形成的氢化物沸点:________更高,热稳定性________更强。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是:
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,22.4LCH4中含有的分子总数为5NA
C.常温常压下,14g氮气含有的原子数为NA
D.标准状况下,铝跟盐酸溶液反应生成1mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道科研人员应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构;②N—N键的键能为167 kJ·mol-1。请回答下列问题:
(1)N60分子组成的晶体为______晶体,其熔、沸点比N2______(填“高”或“低”),原因是________________________。
(2)1 mol N60分解成N2时吸收或放出的热量是________ kJ(已知![]() 键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨在生产中具有重要意义。请按要求回答下列问题。
(1)已知反应N2(g)+3H2(g)![]() 2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1molN2、3molH2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1molN2、3molH2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
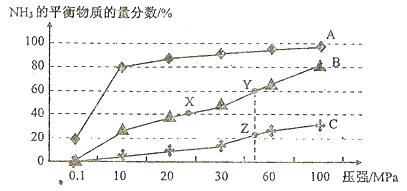
①曲线A、B、C对应的温度是由低到高依次是(填代表曲线的字母)_______。图中X、Y、Z点的平衡常数大小关系(填“>”“<”或“=”):K(X)__K(Y)_____K(Z).
②既能加快化学反应速率有能提高H2的转化率的措施有_______。
③Y点对应的H2的转化率是_______;若仅将起始投料均加倍,其他条件不变,达新平衡时,则H2的转化率将会(填“升高”、“降低”或“不变”) _______ 。
(2)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图甲和图乙所示:
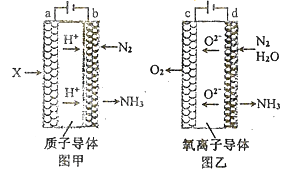
①图甲a电极上的电极反应式为_______图乙d电极上的电极反应式为_______。
②若图甲和图乙装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com