
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
【答案】 D 4 原子 E 2 A 12 C 离子 8 B 分子 12 石墨>金刚石>NaCl>CsCl>干冰
【解析】根据晶体的结构特点来辨别图形所代表的物质。NaCl晶体是立方体结构,每个Na+与6个Cl-紧邻,每个Cl-又与6个Na+紧邻,每个Na+(或Cl-)周围与它最近且距离相等的Na+(或Cl-)有12个。CsCl晶体由Cs+、Cl-构成立方体结构,但Cs+组成的立方体中心有1个Cl-,Cl-组成的立方体中心又镶入一个Cs+,每个Cl-与8个Cs+紧邻,每个Cs+与8个Cl-紧邻。干冰也是立方体结构,但在立方体的每个正方形面的中央都有一个CO2分子,每个CO2分子与12个CO2分子紧邻。金刚石的基本结构单元是正四面体,每个碳原子紧邻4个其他碳原子。石墨的片层结构由正六边形结构组成,每个碳原子紧邻另外3个碳原子,即每个正六边形占有1个碳原子的,所以平均每个正六边形占有的碳原子数是6×=2。(6)离子晶体的熔点由其离子键的强弱决定,由于半径Na+<Cs+,所以熔点NaCl>CsCl。石墨虽为混合晶体,但粒子间作用力有范德华力、共价键,若要熔化,不仅要破坏范德华力,还要破坏共价键,且石墨中碳碳键的键长比金刚石中碳碳键的键长短,所以石墨中碳碳键的键能比金刚石中碳碳键的大,则石墨的熔点比金刚石的熔点要高。


科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,可用于自来水消毒。1868年,狄肯等科学家发明了在氯化铜催化并加热的条件下,利用空气中的氧气氧化氯化氢制取氯气的方法,译为地康法。其原理可表示为4HCl+O2![]() 2H2O+2Cl2,下列说法正确的是()
2H2O+2Cl2,下列说法正确的是()
A. Cl2是还原产物
B. 生成11.2LCl2(标准状况),转移电子数目为2NA
C. 反应中Cl被氧化,HCl得到电子
D. 氧化性:O2>Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图 ,E—的原子结构示意图 。
(2)写出BCD的电子式 ,E2C的结构式 。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式 ;DC3中心原子杂化方式 ;
EC4—微粒中的键角 ;BC32—微粒的键角 ;
DE2分子的立体构型 ;B2A2分子的立体构型 。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为 ,π键数目为 。
(5)根据等电子原理,指出与BC2互为等电子体的离子 (一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,某些花岗岩会产生氡(![]() Rn),对人体产生伤害。请回答:
Rn),对人体产生伤害。请回答:
(1)该原子的质量数是________,质子数是________,中子数是________。
(2)请根据Rn的原子结构预测,氡气的化学性质________。
A.非常活泼,容易与氧气等非金属单质反应
B.比较活泼,能与钠等金属反应
C.不太活泼
D.很难与其他物质发生反应
你选择该选项的理由是______________________________________________。
(3)研究发现,镭能蜕变为![]() Rn,故称
Rn,故称![]() Rn为镭射气;钍能蜕变为
Rn为镭射气;钍能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为钍射气;锕能蜕变为
Rn称为钍射气;锕能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为锕射气。则
Rn称为锕射气。则![]() Rn、
Rn、![]() Rn、
Rn、![]() Rn是________。
Rn是________。
A.同种元素 B.同位素
C.同种核素 D.同种原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.某溶液中加Ba(OH)2溶液生成蓝色沉淀,说明原溶液中有Cu2+
C.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42-
D.某溶液中加稀硫酸溶液产生无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是
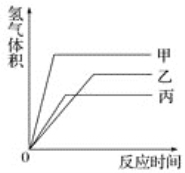
A. 三种金属的活动性顺序为甲>乙>丙
B. 反应结束消耗硫酸的质量一定相同
C. 三种金属的相对原子质量是甲>乙>丙
D. 甲先反应完,乙最后反应完
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为CO2分子晶体结构的一部分,观察图形。试说明每个 CO2分子周围有________个与之紧邻且等距的 CO2分子;该结构单元平均占有________个CO2分子。

(2)在40 GPa高压下,用激光器加热到1800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是________。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4 mol C—O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com