
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
【答案】 bd Al3++3CaF2===3Ca2++AlF![]() V形 sp3 172 低
V形 sp3 172 低
【解析】(1)a、Ca2+与F-间既有静电吸引作用,也有静电排斥作用,错误;b、离子所带电荷相同,F-的离子半径小于Cl-,所以CaF2晶体的晶格能大,则CaF2的熔点高于CaCl2,正确;c、晶体构型还与离子的大小有关,所以阴阳离子比为2∶1的物质,不一定与CaF2晶体构型相同,错误;d、CaF2中的化学键为离子键,CaF2在熔融状态下发生电离,因此CaF2在熔融状态下能导电,正确。答案选bd;(2)CaF2难溶于水,但可溶于含Al3+的溶液中,生成了AlF![]() ,所以离子方程式为:Al3++3CaF2===3Ca2++AlF
,所以离子方程式为:Al3++3CaF2===3Ca2++AlF![]() ;(3)OF2分子中O与2个F原子形成2个σ键,O原子还有2对孤对电子,所以O原子的杂化方式为sp3杂化,空间构型为V型;(4)根据焓变的含义可得:242 kJ·mol-1+3×159 kJ·mol-1-6×ECl-F=313 kJ·mol-1,解得Cl-F键的平均键能ECl-F=172 kJ·mol-1;组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,所以ClF3的熔、沸点比BrF3的低。
;(3)OF2分子中O与2个F原子形成2个σ键,O原子还有2对孤对电子,所以O原子的杂化方式为sp3杂化,空间构型为V型;(4)根据焓变的含义可得:242 kJ·mol-1+3×159 kJ·mol-1-6×ECl-F=313 kJ·mol-1,解得Cl-F键的平均键能ECl-F=172 kJ·mol-1;组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,所以ClF3的熔、沸点比BrF3的低。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】NA 是阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L 以任意比例混合的 H2 和 CO 中所含原子总数为 2NA
B. 由 32.50g FeCl3 制得的 Fe(OH)3 胶体粒子数为 0.2 NA
C. 常温常压下,Na 与 H2O 反应生成 11.2L H2,反应中转移的电子数为 NA
D. 常温常压下,质量均为 16g 的 O2 和 O3 中,电子数分别是 8NA 和 12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2 :1,三个氯离子位于外界。请根据以上情况,回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)B的氢化物分子的空间构型是________,其中心原子采取________杂化。
(3)写出化合物AC2的电子式________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______________。
(4)E的核外电子排布式是________,ECl3形成的配合物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对物质的空间结构的下列说法不正确的是
A. 具有4原子共线的可能含碳碳三键
B. 具有4原子共面一定含醛基
C. 具有6原子共面的可能含碳碳双键
D. 具有12原子共面的可能含苯环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有关热化学方程式为:
① 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ/mol;
4NO(g)+6H2O(g) △H=-905kJ/mol;
② 3H2(g)+N2(g)![]() 2NH3(g) △H=-92.4kJ/mol;
2NH3(g) △H=-92.4kJ/mol;
③ 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol;
④ N2(g)+O2(g)=2NO(g) △H=QkJ/mol;
(1)Q=___________。
(2)向某密闭容器中充入amolNH3、bmolO2后,测得反应体系中某种量值X与压强P、温度T之间的变化如图1所示,图2表示温度为T2时,当容器为1L恒容密闭容器时,容器中NH3的平衡转化率与反应开始时两种反应物的投料之比(用M表示)的关系。
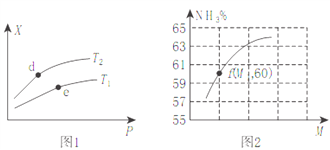
①若X表示NH3的百分含量,则T2_____T1(填>、<、无法确定);d、e两点的正反应的平衡常数K(d)_____K(e)。
②X还可以表示_____________。
a.混合气体的平均摩尔质量 b.NO的产率 c.△H值
③M=__________(用含a、b的式子表示,后同),若f点M=1.25,则此时O2的转化率为_________
(3)有科学家电解原理获得高产率的合成氨,则阴极上的电极反应式为(已知电解质能传递H+)_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com