
【题目】下列化合物的核磁共振氢谱中出现三组峰的是
A. 乙烯 B. 乙醇 C. 乙醛 D. 氯乙烷
科目:高中化学 来源: 题型:
【题目】对氨基苯酚(HOC6H4NH2)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示。下列说法正确的是
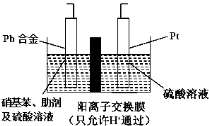
A.电解时Pt电极应与直流电源的负极相连
B.电解时Pt电极上有H2放出
C.阴极反式为:C6H5NO2+4e-+4H+===HOC6H4NH2+H2O
D.电解一段时间后,硫酸溶液的pH不变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图 ,E—的原子结构示意图 。
(2)写出BCD的电子式 ,E2C的结构式 。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式 ;DC3中心原子杂化方式 ;
EC4—微粒中的键角 ;BC32—微粒的键角 ;
DE2分子的立体构型 ;B2A2分子的立体构型 。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为 ,π键数目为 。
(5)根据等电子原理,指出与BC2互为等电子体的离子 (一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:
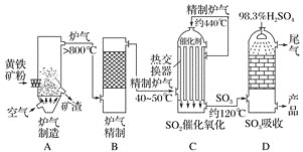
请回答下列问题:
(1)在炉气制造中,黄铁矿粉碎的目的是____________,生成二氧化硫的化学方程式是_____________。
(2)炉气精制的目的是__________________________________。
(3)二氧化硫催化氧化的化学方程式是________________________。
(4)浓硫酸是不是可以用水代替:__________,原因是__________________________________。
(5)尾气的主要成分是__________,若将尾气通入氢氧化钙浊液中,最后能得到的副产品是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
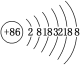
【题目】据报道,某些花岗岩会产生氡(![]() Rn),对人体产生伤害。请回答:
Rn),对人体产生伤害。请回答:
(1)该原子的质量数是________,质子数是________,中子数是________。
(2)请根据Rn的原子结构预测,氡气的化学性质________。
A.非常活泼,容易与氧气等非金属单质反应
B.比较活泼,能与钠等金属反应
C.不太活泼
D.很难与其他物质发生反应
你选择该选项的理由是______________________________________________。
(3)研究发现,镭能蜕变为![]() Rn,故称
Rn,故称![]() Rn为镭射气;钍能蜕变为
Rn为镭射气;钍能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为钍射气;锕能蜕变为
Rn称为钍射气;锕能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为锕射气。则
Rn称为锕射气。则![]() Rn、
Rn、![]() Rn、
Rn、![]() Rn是________。
Rn是________。
A.同种元素 B.同位素
C.同种核素 D.同种原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是
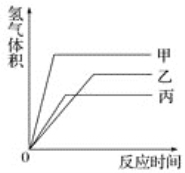
A. 三种金属的活动性顺序为甲>乙>丙
B. 反应结束消耗硫酸的质量一定相同
C. 三种金属的相对原子质量是甲>乙>丙
D. 甲先反应完,乙最后反应完
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com