
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图 ,E—的原子结构示意图 。
(2)写出BCD的电子式 ,E2C的结构式 。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式 ;DC3中心原子杂化方式 ;
EC4—微粒中的键角 ;BC32—微粒的键角 ;
DE2分子的立体构型 ;B2A2分子的立体构型 。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为 ,π键数目为 。
(5)根据等电子原理,指出与BC2互为等电子体的离子 (一种即可)
【答案】(14分)
(1) 2s 2p
↑↓ | ↑ | ↑ |
(2)![]() Cl—O—Cl
Cl—O—Cl
(3) sp3sp2109°28ˊ 120° V形 直线形
(4) 4 1
(5)N3- 、AlO2-、 SCN-、CNO- 等任意一种(2分)
【解析】试题分析:A只有1个未成对电子,且A的原子序数在五种元素中最小,B、C是同周期元素,则A是H元素,B、C是第二周期元素,D、E是第三周期元素,E也只有1个未成对电子,结合E的原子序数和周期,判断E是Cl元素;C、D的价电子层结构相同,则C、D是同主族元素,基态时B、C、D原子核外皆有2个未成对电子,B的原子序数小于C,则B的2p能级有2个电子,C的2p能级有4个电子,所以B是C元素,C是O元素,则D是S元素。
(1)根据以上分析B是C元素,价电子排布图为
↑↓ | ↑ | ↑ |
2s 2p
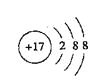
E是Cl元素,Cl-的结构示意图为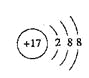
(2)BCD的化学式为COS,根据元素的价键原则,C与O、S分别形成双键,电子式为![]() ;E2C的化学式为Cl2O,所以O分别与Cl原子形成一个共价键,结构式为Cl—O—Cl
;E2C的化学式为Cl2O,所以O分别与Cl原子形成一个共价键,结构式为Cl—O—Cl
(3)根据VSEPR理论,ClO3-的中心原子的价层电子对数=3+1/2(7+1-6)=4,所以中心原子杂化方式是sp3杂化;同理可计算SO3中心原子杂化方式是sp2杂化;ClO4—微粒中的中心原子的杂化方式是sp3杂化,无孤对电子,所以空间构型是正四面体型,键角是109°28ˊ;CO32—微粒的中心原子的杂化方式是sp2杂化,无孤对电子,所以空间构型是平面正三角形,键角是120°;SCl2分子中中心原子的杂化方式是sp3杂化,有2对孤对电子,所以立体构型是V型;C2H2分子中中心原子的杂化方式是sp杂化,立体构型是直线型;
(4)一种由A、B、C三种元素组成的分子A2BC2,化学式为CH2O2,该物质是甲酸,分子中含有4个σ键,1个π键;
(5)与CO2是等电子体的物质的化学式中也是三原子分子,价电子数是16,若为离子则是N3-、AlO2-、 SCN-、CNO- 等。


科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸的原料。氨经一系列反应可以得到硝酸,如图所示:
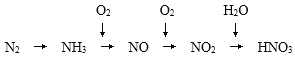
根据已知信息及所学知识回答下列问题:
(1)写出实验室制取氨气的化学方程式_____________;
(2)写出氨的催化氧化的化学方程式_____________;
(3)计算生成1.0mol HNO3需要_______molNH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.铁和稀盐酸反应:2Fe+6H+=2Fe3++H2↑
B.Cu(OH)2和硫酸溶液反应:OH-+H+=H2O
C.Ba(OH)2溶液与盐酸反应:OH-+H+=H2O
D.CaCO3与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2 :1,三个氯离子位于外界。请根据以上情况,回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)B的氢化物分子的空间构型是________,其中心原子采取________杂化。
(3)写出化合物AC2的电子式________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______________。
(4)E的核外电子排布式是________,ECl3形成的配合物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表前四周期的一部分,X、Y、Z、R、Q、W、J是7种元素的代号。回答下列问题时,涉及元素书写的请用相应的元素符号。

(1)J基态原子的核外电子排布式为________。基态Q2+中未成对电子数为________;R和Y的简单离子与Na+半径大小顺序为________。
(2)X、Y、Z三种元素电负性由大到小的排序是________;X与Y的第一电离能:X________(填“>”“<”或“=”)Y,其理由是________。
(3)检验某溶液中是否含有Q3+的方法是_____________________________。
(4)已知WX3是一种引爆剂,受撞击时分解为两种单质,则其化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是:
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,22.4LCH4中含有的分子总数为5NA
C.常温常压下,14g氮气含有的原子数为NA
D.标准状况下,铝跟盐酸溶液反应生成1mol氢气时,转移的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com