
【题目】据报道,某些花岗岩会产生氡(![]() Rn),对人体产生伤害。请回答:
Rn),对人体产生伤害。请回答:
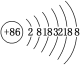
(1)该原子的质量数是________,质子数是________,中子数是________。
(2)请根据Rn的原子结构预测,氡气的化学性质________。
A.非常活泼,容易与氧气等非金属单质反应
B.比较活泼,能与钠等金属反应
C.不太活泼
D.很难与其他物质发生反应
你选择该选项的理由是______________________________________________。
(3)研究发现,镭能蜕变为![]() Rn,故称
Rn,故称![]() Rn为镭射气;钍能蜕变为
Rn为镭射气;钍能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为钍射气;锕能蜕变为
Rn称为钍射气;锕能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为锕射气。则
Rn称为锕射气。则![]() Rn、
Rn、![]() Rn、
Rn、![]() Rn是________。
Rn是________。
A.同种元素 B.同位素
C.同种核素 D.同种原子
【答案】222 86 136 D Rn原子最外层已达8电子稳定结构,因此氡气很稳定 A、B
【解析】
(1)元素符号左下角数字表示质子数、左上角数字表示质量数,中子数=质量数-质子数,据此进行分析;
(2)Rn的原子最外层已达8电子稳定结构,性质稳定;
(3)根据元素、核素、同位素的概念进行分析。
(1) 元素符号左下角数字表示质子数、左上角数字表示质量数,中子数=质量数-质子数,所以该原子质量数是222,质子数是86,中子数=222-86=136;
综上所述,本题答案是:222,86,136。
(2) 该原子结构示意图为 ,最外层有8个电子,性质较稳定,不易和其它物质发生反应,所以D选项是正确的;
,最外层有8个电子,性质较稳定,不易和其它物质发生反应,所以D选项是正确的;
因此,本题正确答案是:D,Rn原子最外层已达8电子稳定结构,因此氡气很稳定。
(3) 这三种微粒的质子数相同、中子数不同,所以是同一元素的不同核素,属于同位素,所以AB选项是正确的;
综上所述,本题选. A、B。


科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表前四周期的一部分,X、Y、Z、R、Q、W、J是7种元素的代号。回答下列问题时,涉及元素书写的请用相应的元素符号。

(1)J基态原子的核外电子排布式为________。基态Q2+中未成对电子数为________;R和Y的简单离子与Na+半径大小顺序为________。
(2)X、Y、Z三种元素电负性由大到小的排序是________;X与Y的第一电离能:X________(填“>”“<”或“=”)Y,其理由是________。
(3)检验某溶液中是否含有Q3+的方法是_____________________________。
(4)已知WX3是一种引爆剂,受撞击时分解为两种单质,则其化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Na+、K+、OH﹣、Cl﹣
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Mg2+、Na+、SO42﹣、Cl﹣
D.Ca2+、HCO3﹣、NO3﹣、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠又称硫化碱,为无色、易溶于水和热乙醇的固体,常用于制造硫代硫酸钠、多硫化钠、硫化染料等。实验室中用工业硫化钠(因含重金属硫化物和煤粉等而呈褐色)、纯碱等物质制备硫代硫酸钠晶体(Na2S2O3·5H2O)的原理如下:Na2CO3+SO2=Na2SO3+CO2 S+ Na2SO3![]() Na2S2O3。回答下列问题:
Na2S2O3。回答下列问题:
(1)工业硫化钠的纯化
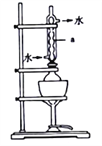
将18g工业硫化钠加入烧瓶中,再加入150mL95%的乙醇溶液和8mL水。用如图所示装置进行沸水浴加热,并回流40min,趁热过滤,冷却、搅拌、结晶、倾析,除去上层母液;最后用95%的乙醇溶液洗涤,烘干,得到Na2S·9H2O晶体。图中仪器a的名称是_______,该过程中回流40min的目的是_______________________________。
(2)硫代硫酸钠的制备
称取纯化后的Na2S·9H2O晶体14.4g和mgNa2CO3,混合后置于锥形瓶中,加入150mL蒸馏水,微热后按图所示组装仪器;然后,打开分液漏斗的活塞和螺旋夹6,并适当调节该螺旋夹,向锥形瓶中通入SO2气体,当溶液呈中性时,停止通入SO2气体,对反应后落液进行后续处理,即可制得硫代硫酸钠(Na2S2O3·5H2O)。
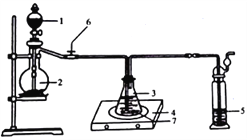
①适当调节螺旋夹6的目的是_______________________________________;
②实验过程中,通入SO2一段时间后,溶液中会生成大量淡黄色沉淀,然后又变澄清。生成淡黄色沉淀的化学方程式为____________________________________。若通入SO2气体时间过长,会降低硫代硫酸钠的产率,原因是_______________________。
③为提高产品纯度,节约原料,m=____g;
④反应结束后,需对溶液进行后续处理,得到硫代硫酸钠晶体(Na2S2O3·5H2O),其操作是蒸发浓缩,冷却结晶、过滤、_____、烘干。称量所得产品,质量为ng,则Na2S2O3·5H2O的产率为_____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道科研人员应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构;②N—N键的键能为167 kJ·mol-1。请回答下列问题:
(1)N60分子组成的晶体为______晶体,其熔、沸点比N2______(填“高”或“低”),原因是________________________。
(2)1 mol N60分解成N2时吸收或放出的热量是________ kJ(已知![]() 键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种)________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com