
【题目】已知有关热化学方程式为:
① 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ/mol;
4NO(g)+6H2O(g) △H=-905kJ/mol;
② 3H2(g)+N2(g)![]() 2NH3(g) △H=-92.4kJ/mol;
2NH3(g) △H=-92.4kJ/mol;
③ 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol;
④ N2(g)+O2(g)=2NO(g) △H=QkJ/mol;
(1)Q=___________。
(2)向某密闭容器中充入amolNH3、bmolO2后,测得反应体系中某种量值X与压强P、温度T之间的变化如图1所示,图2表示温度为T2时,当容器为1L恒容密闭容器时,容器中NH3的平衡转化率与反应开始时两种反应物的投料之比(用M表示)的关系。
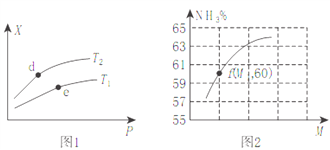
①若X表示NH3的百分含量,则T2_____T1(填>、<、无法确定);d、e两点的正反应的平衡常数K(d)_____K(e)。
②X还可以表示_____________。
a.混合气体的平均摩尔质量 b.NO的产率 c.△H值
③M=__________(用含a、b的式子表示,后同),若f点M=1.25,则此时O2的转化率为_________
(3)有科学家电解原理获得高产率的合成氨,则阴极上的电极反应式为(已知电解质能传递H+)_______________。
【答案】 +180.5 > < a b/a 60% N2+6e-+6H+=2NH3
【解析】(1)根据盖斯定律可知:[①-3×③+2×②]÷2可得:N2(g)+O2(g)=2NO(g), △H=. +180.5 kJ/mol;正确答案:+180.5。
(2) ①若X表示NH3的百分含量,该反应为放热反应,升高温度,平衡左移,NH3的百分含量增大,因此T2>T1;由于该反应放热,升高温度,平衡左移,平衡常数减小,温度d点大于 e点,因此d、e两点的正反应的平衡常数K(d)<k(e);正确答案:></k(e);正确答案:> ; <。
②该反应反应前后混合气体的总质量不变,增大压强,平衡左移,混合气体的总量减小,混合气体的平均摩尔质量增大;该反应放热,升高温度,平衡左移,混合气体的平均摩尔质量增大;a正确;增大压强,平衡左移,NO的产率降低,b错误;一个固定的反应,△H为定值,c错误;所以X可以表示混合气体的平均摩尔质量;正确选项a。
③根据4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ/mol可知,如果增大氧气的浓度,氨气的转化率增大;根据图像曲线变化可知,M=b/a,比值越大,氨气的转化率越高;根据M=b/a,若f点M=1.25可知,假设氧气为1.25mol, 则氨气为1mol,氨气的转化率为60%,则氨气变化了0.6mol,氧气变化了0.6×5/4=0.75mol, 则此时O2的转化率为0.75/1.25×100%=60%;正确答案:b/a 60%。
4NO(g)+6H2O(g) △H=-905kJ/mol可知,如果增大氧气的浓度,氨气的转化率增大;根据图像曲线变化可知,M=b/a,比值越大,氨气的转化率越高;根据M=b/a,若f点M=1.25可知,假设氧气为1.25mol, 则氨气为1mol,氨气的转化率为60%,则氨气变化了0.6mol,氧气变化了0.6×5/4=0.75mol, 则此时O2的转化率为0.75/1.25×100%=60%;正确答案:b/a 60%。
(3)氮气和氢气合成氨气,电解池中,氮气在阴极得电子,在酸性条件下变为氨气,电极反应式为:N2+6e-+6H+=2NH3;正确答案:N2+6e-+6H+=2NH3。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及合金在生产生活中应用日趋广泛。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3杂质,SiO2在“碱溶”时转化为铝硅酸钠沉淀)为原料制备铝的一种工艺流程如下:
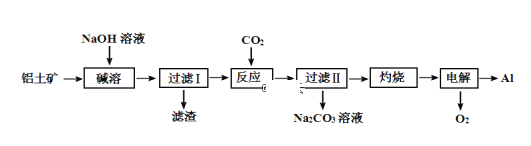
(1)“过滤Ⅰ”时滤渣的主要成分为 ______________ 、______________。
(2)“碱溶”时生成偏铝酸钠的离子方程式为____________________________。
(3)“反应”时,也可以用NaHCO3代替CO2,写出加入NaHCO3溶液后的离子方程式________________。
(4)“电解”时加入冰晶石的作用是___________________________________。
(5)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气存在下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②1mol镁铝合金(Mg17Al12)分别与足量的盐酸、氢氧化钠溶液充分反应,生成的氢气在相同条件下的体积比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
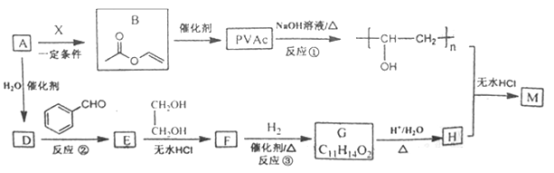
己知:R、R1、R2为H原子或烃基
Ⅰ. 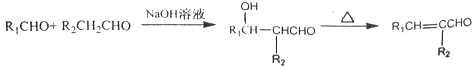
Ⅱ. 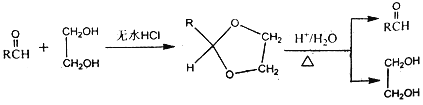
Ⅲ.羟基连在碳碳双键或碳碳三键上不稳定。
(1)已知标准状况下,4.48L气态烃A的质量是5.2g,A→B为加成反应,则X的结构简式为__________________;B中官能团的名称是_______________________。
(2)E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是________________,在E→F→G→H的转化过程中,乙二醇的作用是___________________________________。
(3)反应①的化学方程式为_________________________________________。
(4)己知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为_________________。
(5)E的同分异构体中含有苯环和甲基,且甲基不与苯环直接相连的同分异构体有_____种。
(6)以甲醛、苯乙醛(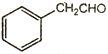 )以及上述合成路线中的必要有机试剂为原料合成
)以及上述合成路线中的必要有机试剂为原料合成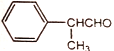 (其他无机试剂任选),请写出合成路线。______________________
(其他无机试剂任选),请写出合成路线。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为CO2分子晶体结构的一部分,观察图形。试说明每个 CO2分子周围有________个与之紧邻且等距的 CO2分子;该结构单元平均占有________个CO2分子。

(2)在40 GPa高压下,用激光器加热到1800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是________。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4 mol C—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求进行填空:
(1)6.20 g Na2O 晶体中含 Na+的物质的量是 _________________。
(2)等质量的 NH3 和 H2S 中,氢原子的个数比是______________________。
(3) 铁与水蒸气反应的化学方程式_______________________________________。
(4) 向少量氯化铝溶液中加入足量氢氧化钠的离子方程式________________________。
(5)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应式为:C6H12O6+6O26CO2+6H2O+能量,该反应中的还原剂是______,若在该反应中消耗氧化剂的体积在标准状况下为4.48L,则反应中转移电子的物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时消耗2nmolNO2
②单位时间内生成nmolO2的同时消耗2nmolNO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ②④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com