
【题目】按要求进行填空:
(1)6.20 g Na2O 晶体中含 Na+的物质的量是 _________________。
(2)等质量的 NH3 和 H2S 中,氢原子的个数比是______________________。
(3) 铁与水蒸气反应的化学方程式_______________________________________。
(4) 向少量氯化铝溶液中加入足量氢氧化钠的离子方程式________________________。
(5)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应式为:C6H12O6+6O26CO2+6H2O+能量,该反应中的还原剂是______,若在该反应中消耗氧化剂的体积在标准状况下为4.48L,则反应中转移电子的物质的量为_______。
【答案】0.2mol 3:1 3Fe + 4H2O![]() Fe3O4 + 4H2 Al3++4OH-=AlO2-+2H2O C6H12O6 0.8mol
Fe3O4 + 4H2 Al3++4OH-=AlO2-+2H2O C6H12O6 0.8mol
【解析】
(1)Na2O的相对分子质量为62。
(2)等质量的 NH3和H2S假设都为1克,NH3和H2S的物质的量分别为:1/17mol和1/34mol。
(3)铁与水蒸气反应的化学方程式:3Fe + 4H2O![]() Fe3O4 + 4H2。
Fe3O4 + 4H2。
(4)向少量氯化铝溶液中加入足量氢氧化钠的离子方程式:Al3++4OH-=AlO2-+2H2O。
(5)该反应C6H12O6+6O26CO2+6H2O,6mol O2参与反应转移的电子数为24mol。
(1)Na2O的相对分子质量为62,6.20 g Na2O为0.1mol,Na+的物质的量是是0.2 mol,答案为:0.2mol。
(2)等质量的 NH3和H2S假设都为1克,NH3和H2S的物质的量分别为:1/17mol和1/34mol,氢原子物质的量分别为3/17mol和1/17mol,氢原子的个数比是3:1,故答案为3:1。
(3)铁与水蒸气反应的化学方程式:3Fe + 4H2O![]() Fe3O4 + 4H2,故答案为:3Fe + 4H2O
Fe3O4 + 4H2,故答案为:3Fe + 4H2O![]() Fe3O4 + 4H2。
Fe3O4 + 4H2。
(4)向少量氯化铝溶液中加入足量氢氧化钠的离子方程式:Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O。
(5)C6H12O6+6O26CO2+6H2O,该反应中O2中氧元素化合价从0价降为-2价,所以氧气是氧化剂,还原剂是C6H12O6,氧气在标准状况下为4.48L,物质的量为0.2mol,根据反应方程式可知6mol O2参与反应转移的电子数为24mol, 0.2mol O2参与反应转移的电子数为0.8 mol,故答案为:0.8mol。


科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是空间立体网状结构,如图所示。下列关于二氧化硅晶体的说法中不正确的是( )
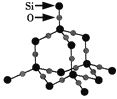
A. 1 mol SiO2晶体中含2 mol Si—O键 B. 晶体中Si、O原子个数比为1:2
C. 晶体中Si、O原子最外电子层都满足8电子稳定结构 D. 晶体中最小环上的原子数为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有关热化学方程式为:
① 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ/mol;
4NO(g)+6H2O(g) △H=-905kJ/mol;
② 3H2(g)+N2(g)![]() 2NH3(g) △H=-92.4kJ/mol;
2NH3(g) △H=-92.4kJ/mol;
③ 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol;
④ N2(g)+O2(g)=2NO(g) △H=QkJ/mol;
(1)Q=___________。
(2)向某密闭容器中充入amolNH3、bmolO2后,测得反应体系中某种量值X与压强P、温度T之间的变化如图1所示,图2表示温度为T2时,当容器为1L恒容密闭容器时,容器中NH3的平衡转化率与反应开始时两种反应物的投料之比(用M表示)的关系。
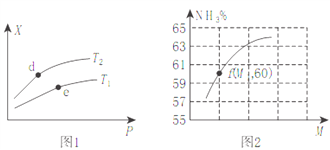
①若X表示NH3的百分含量,则T2_____T1(填>、<、无法确定);d、e两点的正反应的平衡常数K(d)_____K(e)。
②X还可以表示_____________。
a.混合气体的平均摩尔质量 b.NO的产率 c.△H值
③M=__________(用含a、b的式子表示,后同),若f点M=1.25,则此时O2的转化率为_________
(3)有科学家电解原理获得高产率的合成氨,则阴极上的电极反应式为(已知电解质能传递H+)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 Na2SO4、MgSO4、H2SO4 溶于水配成 0.2 L 混合溶液,部分离子浓度如图 所示,下列说法错误的( )
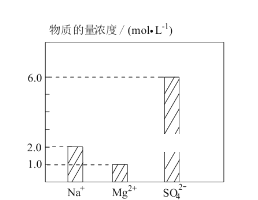
A. 该混合溶液中 Na2SO4 的物质的量为 0.2 mol
B. 该混合溶液中 H+的物质的量浓度为 8mol·L-1
C. 若将该混合溶液加水稀释至体积为 1 L,稀释后溶液中SO42-的物质的量浓度为 1.2 mol·L-1
D. 若向该混合溶液中逐滴加入 2 mol·L-1NaOH 溶液至Mg2+恰好完全沉淀,需 NaOH 溶液 200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
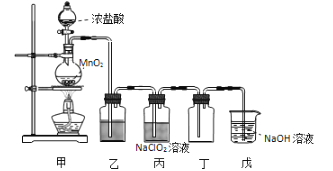
(1)甲装置中圆底烧瓶内发生反应的化学方程式是____________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。实验过程中常需通入适量的 N2稀释 ClO2,其目的是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO2-、ClO3-,该反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果与图像不相符的是

A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1:2,则加入铝粉的质量为( )
A. 1.8 g B. 2.7 g C. 3.6 g D. 5.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、CO32-、SO42-中的几种。
①若加入锌粒,最终产生无色无味的气体;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示,则下列说法正确的是( )
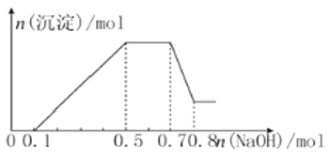
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中n(NH4+)=0.2 mol
C. 溶液中一定不含CO32-,可能含有SO42-
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com