
����Ŀ�����ǵؿ��к�����ߵĽ���Ԫ�أ��䵥�ʼ��Ͻ�������������Ӧ�������㷺����������(��Ҫ�ɷ�ΪAl2O3����SiO2��Fe2O3���ʣ�SiO2����������ʱת��Ϊ�������Ƴ���)Ϊԭ���Ʊ�����һ�ֹ����������£�
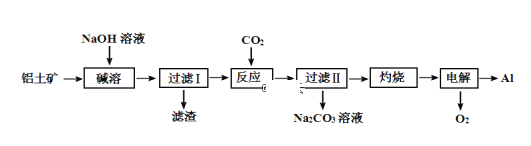
(1)�����ˢ���ʱ��������Ҫ�ɷ�Ϊ ______________ ��______________��
(2)��������ʱ����ƫ�����Ƶ����ӷ���ʽΪ____________________________��
(3)����Ӧ��ʱ��Ҳ������NaHCO3����CO2��д������NaHCO3��Һ������ӷ���ʽ________________��
(4)�������ʱ�������ʯ��������___________________________________��
(5)þ���Ͻ�(Mg17Al12)��һ��DZ�ڵ�������ϣ�������������£���һ����ѧ�����ȵ�Mg��Al������һ���¶���������á�
�������Ʊ�þ���Ͻ�(Mg17Al12)ʱͨ�������Ŀ����_________________��
��1molþ���Ͻ�(Mg17Al12)�ֱ������������ᡢ����������Һ��ַ�Ӧ�����ɵ���������ͬ�����µ������Ϊ________________��
���𰸡�Fe2O3 �������Ƴ��� Al2O3 + 2OH�� = 2AlO2 ��+ H2O �� ���ۼ� ������ 35:18
��������
����������Ҫ�ɷ�ΪAl2O3����SiO2��Fe2O3�����ʣ�Ϊԭ���Ʊ�����������ͼ��֪����NaOH�ܽ�ʱFe2O3����Ӧ������Ϣ��֪SiO2�ڡ����ܡ�ʱת��Ϊ�������Ƴ��������˵õ�������ΪFe2O3���������ƣ�������̼��ƫ�����Ʒ�Ӧ����Al��OH��3������II�õ�Al��OH��3�������������������������������Al���������ݴ˴��⡣
��1��������ͼ��֪����NaOH�ܽ�ʱFe2O3����Ӧ������Ϣ��֪SiO2����������ʱת��Ϊ�������Ƴ��������˵õ�������ΪFe2O3���������Ƴ������ʴ�Ϊ��Fe2O3���������Ƴ�����
��2����������ʱNaOH��Һ��Al2O3��Ӧ����ƫ�����ƺ�ˮ����Ӧ�����ӷ���ʽΪAl2O3+2OH-�T2AlO2-+H2O���ʴ�Ϊ��Al2O3+2OH-�T2AlO2-+H2O��
��3������NaHCO3��Һ��̼��������Һ��ƫ��������Һ��Ӧ�����ӷ���ʽΪ��HCO3-+AlO2-+H2O=CO32-+Al(OH)3�����ʴ�Ϊ��HCO3-+AlO2-+H2O=CO32-+Al(OH)3����
��4���������������۵�ߣ��������ʯ�����ۼ������������������۵㣬�����ܺģ��ʴ�Ϊ�����ۼ���
��5����þ�������ǻ��õĽ������ʣ����ױ������е�����������ͨ����������������Է�ֹ���߱��������ʴ�Ϊ����������
��þ���Ͻ��е�þ�������������ᷴӦ����H2����Ӧ����ʽΪ��Mg��2HCl��MgCl2��H2����2Al��6HCl��2AlCl3��3H2����1molMg17Al12�����ᷴӦ�������������ʵ���Ϊ17mol+12mol��3/2=35mol��þ���Ͻ���ֻ����������������Һ��Ӧ������������Ӧ����ʽΪ��2Al��2NaOH��2H2O��2NaAlO2��3H2����1molMg17Al12���������Ʒ�Ӧ�������������ʵ���Ϊ12mol��3/2=18mol���������ɵ���������ͬ�����µ������Ϊ35:18���ʴ�Ϊ��35:18��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵����A<B<C<D<E������A��B��C��ͬһ���ڵķǽ���Ԫ�ء�������DC�ľ���Ϊ���Ӿ��壬D�Ķ�����������C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��AC2Ϊ�Ǽ��Է��ӡ�B��C���⻯��ķе������ͬ����������Ԫ���⻯��ķе�ߡ�E��ԭ������Ϊ24��ECl3����B��C���⻯���γ�����λ��������������������ʵ���֮��Ϊ2 ��1������������λ����硣���������������ش��������⣺
(1)A��B��C�ĵ�һ��������С�����˳��Ϊ________��
(2)B���⻯����ӵĿռ乹����________��������ԭ�Ӳ�ȡ________�ӻ���
(3)д��������AC2�ĵ���ʽ________��һ����B��C��ɵĻ�������AC2��Ϊ�ȵ����壬�仯ѧʽΪ______________��
(4)E�ĺ�������Ų�ʽ��________��ECl3�γɵ������Ļ�ѧʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϸ������������£�������������Һ��Ӧ���ɰ�ɫ��״�� Fe(OH)2�����������������Ѹ�� ��Ϊ����ɫ�����γɺ��ɫ�����������������Ʊ����������ϸ����������ṩ�Ʊ��������£�
����һ���� FeSO4 ��Һ���ò��� O2 ������ˮ���Ƶ� NaOH ��Һ��Ӧ�Ʊ���
(1)���� FeSO4 ��Һʱ��������۵�ԭ����_____����ȥ����ˮ���ܽ�� O2������_____�ķ�����
(2)���ɰ�ɫ Fe(OH)2 �����IJ������ó��ι���ȡ���� O2 �� NaOH ��Һ������ FeSO4 ��ҺҺ���£��ټ��� NaOH ��Һ������������������_____��
��������
����ͼװ���У��� NaOH ��Һ����м��ϡ H2SO4 ���Լ��Ʊ���

(1)���Թܢ��������Լ���_____��
(2)���Թܢ��������Լ���_____��
(3)Ϊ���Ƶð�ɫ Fe(OH)2 ���������Թܢ�͢��м����Լ�����ֹˮ�����������Ӻ��ʵ�鲽�� ��_____��
(4)�������ɵ� Fe(OH)2 �����ܽϳ�ʱ�䱣�ְ�ɫ����������_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵĿռ�ṹ������˵������ȷ����
A. ����4ԭ�ӹ��ߵĿ��ܺ�̼̼����
B. ����4ԭ�ӹ���һ����ȩ��
C. ����6ԭ�ӹ���Ŀ��ܺ�̼̼˫��
D. ����12ԭ�ӹ���Ŀ��ܺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���ᡢ��������ƺ���ʯ�ҷֱ������ᡢ��κ�������
B.����Ԫ������Ķ��ٽ����ʷ�Ϊ������ͻ����
C.ͨ������£���������ӦA2 + 2B��= 2A��+ B2������������A2
D.̼��������ˮ�еĵ��뷽��ʽ��NaHCO3=Na++H++CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����������˵����ȷ���ǣ�
A.��״���£�5.6L���Ȼ�̼���еķ�����Ϊ0.25NA
B.��״���£�22.4LCH4�к��еķ�������Ϊ5NA
C.���³�ѹ�£�14g�������е�ԭ����ΪNA
D.��״���£�����������Һ��Ӧ����1mol����ʱ��ת�Ƶĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������辧���ǿռ�������״�ṹ����ͼ��ʾ�����й��ڶ������辧���˵���в���ȷ����( )
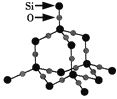
A. 1 mol SiO2�����к�2 mol Si��O�� B. ������Si��Oԭ�Ӹ�����Ϊ1��2
C. ������Si��Oԭ��������Ӳ㶼����8�����ȶ��ṹ D. ��������С���ϵ�ԭ����Ϊ12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�й��Ȼ�ѧ����ʽΪ��
�� 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H=-905kJ/mol��
4NO(g)+6H2O(g) ��H=-905kJ/mol��
�� 3H2(g)+N2(g)![]() 2NH3(g) ��H=-92.4kJ/mol��
2NH3(g) ��H=-92.4kJ/mol��
�� 2H2(g)+O2(g)=2H2O(g) ��H=-483.6kJ/mol��
�� N2(g)+O2(g)=2NO(g) ��H=QkJ/mol��
(1)Q=___________��
(2)��ij�ܱ������г���amolNH3��bmolO2��÷�Ӧ��ϵ��ij����ֵX��ѹǿP���¶�T֮��ı仯��ͼ1��ʾ��ͼ2��ʾ�¶�ΪT2ʱ��������Ϊ1L�����ܱ�����ʱ��������NH3��ƽ��ת�����뷴Ӧ��ʼʱ���ַ�Ӧ���Ͷ��֮��(��M��ʾ)�Ĺ�ϵ��
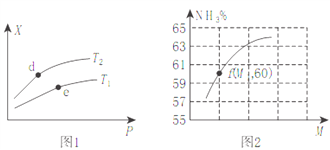
����X��ʾNH3�İٷֺ�������T2_____T1(��>��<����ȷ��)��d��e���������Ӧ��ƽ�ⳣ��K(d)_____K(e)��
��X�����Ա�ʾ_____________��
a.��������ƽ��Ħ������ b.NO�IJ��� c.��Hֵ
��M=__________(�ú�a��b��ʽ�ӱ�ʾ����ͬ)����f��M=1.25�����ʱO2��ת����Ϊ_________
(3)�п�ѧ�ҵ��ԭ����ø߲��ʵĺϳɰ����������ϵĵ缫��ӦʽΪ(��֪������ܴ���H+)_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס������ձ��и�ʢ��100 mL 3 mol��L��1�������NaOH��Һ�������ձ��зֱ��������������ۣ���Ӧ����������ɵ����������ΪV(��)��V(��)��1:2����������۵�����Ϊ( )
A. 1.8 g B. 2.7 g C. 3.6 g D. 5.4 g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com