
����Ŀ��������(Warfarin)����ɱ���飬������ʳƷҩƷ�ල��������Ϊ��Ѫ�ܼ������ٴ�ҩ���ϳ�·��(���ַ�Ӧ������ȥ)������ʾ:

�ش���������:
(1)A������Ϊ_______��E�й���������Ϊ________��
(2)B�Ľṹ��ʽΪ________��
(3)��C����D�Ļ�ѧ����ʽΪ_________
(4)�ݵķ�Ӧ����Ϊ______����ķ�Ӧ����Ϊ_________��
(5)F��ͬ���칹���У�ͬʱ��������������ͬ���칹�干��__________�֡�
a������FeCl3��Һ������ɫ��Ӧ b���ܷ���������Ӧ
���к˴Ź�������Ϊ�����Ľṹ��ʽΪ_________��
(6)���������ϳ�·�ߣ����һ���ɱ���(![]() )��������(CH3CO)2O�ͱ���ȩ(
)��������(CH3CO)2O�ͱ���ȩ(![]() )Ϊԭ�ϣ��Ʊ�
)Ϊԭ�ϣ��Ʊ� �ĺϳ�·��(�������Լ���ѡ)_____��
�ĺϳ�·��(�������Լ���ѡ)_____��
���𰸡� �ױ� ���� ![]()
![]() ȡ����Ӧ �ӳɷ�Ӧ 13
ȡ����Ӧ �ӳɷ�Ӧ 13 ![]()
�������������л�����ƶϺͺϳɣ���1������A����ʽ���Ƴ�AΪ�ױ�����ṹ��ʽΪ ������E�Ľṹ��ʽ���Ƴ�E�к��еĹ���������������2�����ݷ�Ӧ�ٵ�����������ȡ����Ӧ����ԭ��ȡ�����ϵ���ԭ�ӣ���B�Ľṹ��ʽΪ
������E�Ľṹ��ʽ���Ƴ�E�к��еĹ���������������2�����ݷ�Ӧ�ٵ�����������ȡ����Ӧ����ԭ��ȡ�����ϵ���ԭ�ӣ���B�Ľṹ��ʽΪ![]() ����3����Ӧ�ڷ���ˮ�ⷴӦ����C�Ľṹ��ʽΪ
����3����Ӧ�ڷ���ˮ�ⷴӦ����C�Ľṹ��ʽΪ �����ݷ�Ӧ�۵��������������Ǵ�������������Ӧ����ʽΪ
�����ݷ�Ӧ�۵��������������Ǵ�������������Ӧ����ʽΪ![]() ����4���Աȷ�Ӧ��ǰ��Ľṹ��ʽ����Ӧ�ݷ�������ȡ����Ӧ���Աȷ�Ӧ���ǰ���л���Ľṹ��ʽ���Ƴ���Ӧ��Ϊ�ӳɷ�Ӧ����5������FeCl3��Һ��Ӧ������ɫ��Ӧ��˵�����з��ǻ����ܷ���������Ӧ��˵������ȩ�������������Ľṹ��
����4���Աȷ�Ӧ��ǰ��Ľṹ��ʽ����Ӧ�ݷ�������ȡ����Ӧ���Աȷ�Ӧ���ǰ���л���Ľṹ��ʽ���Ƴ���Ӧ��Ϊ�ӳɷ�Ӧ����5������FeCl3��Һ��Ӧ������ɫ��Ӧ��˵�����з��ǻ����ܷ���������Ӧ��˵������ȩ�������������Ľṹ��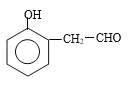 ���ڼ�����֣���
���ڼ�����֣��� ��ȩ���ڱ�������4��λ������
��ȩ���ڱ�������4��λ������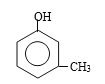 ��ȩ���ڱ�������4��λ������
��ȩ���ڱ�������4��λ������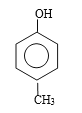 ��ȩ���ڱ�������2��λ�ã�������13�֣��˴Ź���������5��壬˵����5�ֲ�ͬ����ԭ�ӣ���˷��������Ľṹ��ʽΪ
��ȩ���ڱ�������2��λ�ã�������13�֣��˴Ź���������5��壬˵����5�ֲ�ͬ����ԭ�ӣ���˷��������Ľṹ��ʽΪ![]() ����6�����ݺϳɻ������б��Ӳ����·�ߣ�������ĺϳ�·��Ϊ
����6�����ݺϳɻ������б��Ӳ����·�ߣ�������ĺϳ�·��Ϊ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯������ͨ��һ����Ӧֱ����ɵ���
A. Al(OH)3 �� Al2O3 B. Al2O3 �� Al(OH)3
C. Al �� AlO2- D. Al3+ �� Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
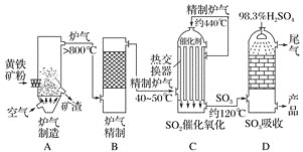
����Ŀ���Ի�����Ϊԭ�ϣ����ýӴ���������������̿ɼ�ʾ���£�
��ش��������⣺
(1)��¯�������У�����������Ŀ����____________�����ɶ�������Ļ�ѧ����ʽ��_____________��
(2)¯�����Ƶ�Ŀ����__________________________________��
(3)��������������Ļ�ѧ����ʽ��________________________��
(4)Ũ�����Dz��ǿ�����ˮ���棺__________��ԭ����__________________________________��
(5)β������Ҫ�ɷ���__________������β��ͨ������������Һ�У�����ܵõ��ĸ���Ʒ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ�����Ҫ��Ⱦ��ɲ���ǿ�����������ѳ����ȷֽ�ȷ��������������
����֪:
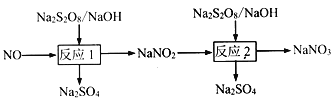
(1)д����Ӧ1�����ӷ���ʽ___________��
(2)�ڷ�Ӧ2��,NO2���ij�ʼŨ��Ϊ0.1mol��L��1,��ӦΪNO2��+S2O82��+2OH-![]() NO3��+2SO42��+H2O����ͬ�¶��£��ﵽƽ��ʱNO2�����ѳ������������(Na2S2O8)��ʼŨ���Ĺ�ϵ����ͼ��ʾ��
NO3��+2SO42��+H2O����ͬ�¶��£��ﵽƽ��ʱNO2�����ѳ������������(Na2S2O8)��ʼŨ���Ĺ�ϵ����ͼ��ʾ��

�ٱȽ�a��b��ķ�Ӧ����:va��_______vb��(���>����<����=��)
�������¶ȵ����ߣ��÷�Ӧ�Ļ�ѧƽ�ⳣ��K______(����������䡱��С��)��
����֪90��ʱ��Kw=3.6��10��13����b���Ӧ��pHΪ12,����¶���K=_____(����һλС��)��
(3)��ҵ��������ƺ�����Ļ��Һ�Ʊ���������(Na2S2O8),�����ĵ缫��ӦʽΪ_______��
��N2O�ڽ�۱��淢���ȷֽ⣺2N2O(g)=2N2(g)+O2(g) ��H��
�ش���������:
(4)��֪:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) ��H1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ��H2
��H=_____��(����H1����H2�Ĵ���ʽ)
(5)ij�¶���,���c(N2O)��ʱ��t�仯��ϵ��ͼ��ʾ��
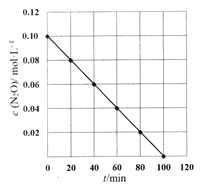
��֪˲ʱ��Ӧ����v��c(N2O)�Ĺ�ϵΪv=kcn(N2O)(k�Ƿ�Ӧ���ʳ���),��k=________,n=_____.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ȼ���г���CaF2����ʽ���ڡ�
(1)���й���CaF2�ı�����ȷ����________��
a��Ca2����F��������ھ�����������
b��F�������Ӱ뾶С��Cl������CaF2���۵����CaCl2
c���������ӱ�Ϊ2��1�����ʣ�����CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
(2)CaF2������ˮ���������ں�Al3������Һ�У�ԭ����_______________(�����ӷ���ʽ��ʾ)����֪AlF![]() ����Һ�п��ȶ����ڡ�
����Һ�п��ȶ����ڡ�
(3)F2ͨ��ϡNaOH��Һ�п�����OF2��OF2���ӹ���Ϊ________��������ԭ�ӵ��ӻ���ʽΪ________��
(4)F2������±�ص��ʷ�Ӧ�����γ�±�ػ��������ClF3��BrF3�ȡ���֪��ӦCl2(g)��3F2(g)===2ClF3(g)����H����313 kJ��mol��1��F��F���ļ���Ϊ159 kJ��mol��1��Cl��Cl���ļ���Ϊ242 kJ��mol��1����ClF3��Cl��F����ƽ������Ϊ________kJ��mol��1��ClF3���ۡ��е��BrF3��________(��ߡ��͡�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǽ����پ����е�һ�������Ľṹʾ��ͼ������һ�����������ṹ��ʵ���ý����ٵ��ܶ�Ϊ19.30 g��cm��3���ٵ����ԭ��������183.9�����������ԭ��Ϊ�Ⱦ�������������������⣺
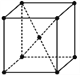
(1) ÿһ�������з�̯��________����ԭ�ӡ�
(2) ���㾧���ı߳�a_____��
(3) �����ٵ�ԭ�Ӱ뾶r_____ (��ʾ��ֻ����Խ����ϵĸ�������DZ˴˽Ӵ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ����Na+��Al3+��Cl����SO42�� �������ӣ���֪ǰ�������ӵĸ�����Ϊ3��2��1������Һ��Al3+�� SO42�������Ӹ�����Ϊ��������
A.1��2
B.1��4
C.3��4
D.3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�PVAc��һ�־��������Ե���֬���ɺϳ���Ҫ�߷��Ӳ���M���ϳ�·�����£�
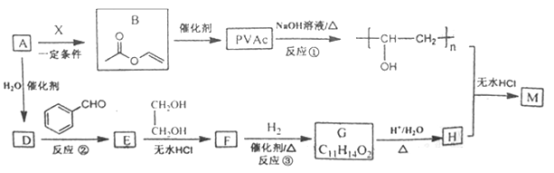
��֪��R��R1��R2ΪHԭ�ӻ�����
��. 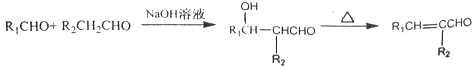
��. 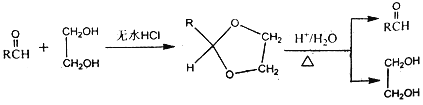
��.�ǻ�����̼̼˫����̼̼�����ϲ��ȶ���
��1����֪��״���£�4.48L��̬��A��������5.2g��A��BΪ�ӳɷ�Ӧ����X�Ľṹ��ʽΪ__________________��B�й����ŵ�������_______________________��
��2��E��ʹ������Ȼ�̼��Һ��ɫ����Ӧ�ڵķ�Ӧ�Լ���������________________����E��F��G��H��ת�������У��Ҷ�����������___________________________________��
��3����Ӧ�ٵĻ�ѧ����ʽΪ_________________________________________��
��4����֪M�������г������⣬��������Ԫ��״�ṹ����M�Ľṹ��ʽΪ_________________��
��5��E��ͬ���칹���к��б����ͼ����Ҽ����뱽��ֱ��������ͬ���칹����_____�֡�
��6���Լ�ȩ������ȩ(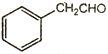 )�Լ������ϳ�·���еı�Ҫ�л��Լ�Ϊԭ�Ϻϳ�
)�Լ������ϳ�·���еı�Ҫ�л��Լ�Ϊԭ�Ϻϳ�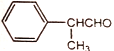 (�������Լ���ѡ)����д���ϳ�·�ߡ�______________________
(�������Լ���ѡ)����д���ϳ�·�ߡ�______________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com