
【题目】氯气是一种重要的化工原料,可用于自来水消毒。1868年,狄肯等科学家发明了在氯化铜催化并加热的条件下,利用空气中的氧气氧化氯化氢制取氯气的方法,译为地康法。其原理可表示为4HCl+O2![]() 2H2O+2Cl2,下列说法正确的是()
2H2O+2Cl2,下列说法正确的是()
A. Cl2是还原产物
B. 生成11.2LCl2(标准状况),转移电子数目为2NA
C. 反应中Cl被氧化,HCl得到电子
D. 氧化性:O2>Cl2
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要________(填仪器名称);
(2)装置C的作用是_____________________________;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______________________________________。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是___________________;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作③。
①55℃蒸发结晶; ②趁热过滤; ③___________;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是______;
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是_________________;
②所称取的样品中NaClO2的物质的量为_______________(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸的原料。氨经一系列反应可以得到硝酸,如图所示:
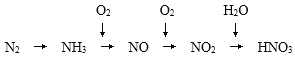
根据已知信息及所学知识回答下列问题:
(1)写出实验室制取氨气的化学方程式_____________;
(2)写出氨的催化氧化的化学方程式_____________;
(3)计算生成1.0mol HNO3需要_______molNH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 是阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L 以任意比例混合的 H2 和 CO 中所含原子总数为 2NA
B. 由 32.50g FeCl3 制得的 Fe(OH)3 胶体粒子数为 0.2 NA
C. 常温常压下,Na 与 H2O 反应生成 11.2L H2,反应中转移的电子数为 NA
D. 常温常压下,质量均为 16g 的 O2 和 O3 中,电子数分别是 8NA 和 12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.铁和稀盐酸反应:2Fe+6H+=2Fe3++H2↑
B.Cu(OH)2和硫酸溶液反应:OH-+H+=H2O
C.Ba(OH)2溶液与盐酸反应:OH-+H+=H2O
D.CaCO3与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com