
【题目】下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1mol任何物质体积均为22.4L/mol
科目:高中化学 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的400mL 0.1molL﹣1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100mL,则NaOH 溶液的浓度为( )
A. 0.1 molL﹣1 B. 0.2 molL﹣1 C. 0.4 molL﹣1 D. 0.8 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温常压下,22.4 L CO2中含有NA个CO2分子
B. 标况下22.4 L空气含有NA个单质分子
C. 22.4 L Cl2中含有NA个Cl2分子
D. 标况下1.12L O2和1.12L CO2均含有0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 分类法对研究化学物质和化学反应有重要的意义,请完成下列问题。今有七种物质: ①铝线 ②熔化的KNO3 ③氯气 ④NaCl晶体 ⑤液态氯化氢 ⑥石灰水 ⑦乙醇,其中能导电的物质是_______,属于电解质的是____,属于非电解质的是__。写出⑥与足量碳酸氢钠溶液反应的离子方程式:_____。
Ⅱ.实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 _____________________________。
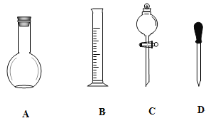
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取NaOH固体的质量为_______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”)。
(4)若用18.4mol/L的浓硫酸进行配制,所需该浓硫酸的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁发生电化学腐蚀的正极反应式:Fe -2e- == Fe2+
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是自然界中形成化合物种类最多的元素,CO和CO2是碳的最常见氧化物。
(1)研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2,其过程如图1所示。过程①的化学方程式是______。在过程②中每产生0.1molO2,转移电子______mol。

(2)在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJmol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
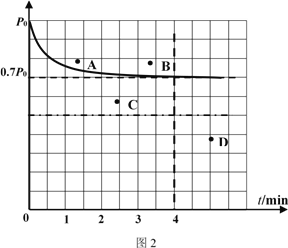
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2,控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为______;温度T1 下,该反应的化学平衡常为______。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是______(填字母)。
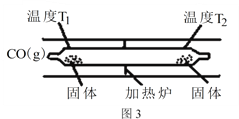
(3)工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池,某种锂离子电池的结构示意图如下,它在放电时有关离子转化关系如图所示,下列说法正确的是

A. Li+透过膜除允许Li+通过外,还允许H2O分子通过
B. 充电时,电池内部发生的总反应为Li++Fe2+![]() Li+Fe3+
Li+Fe3+
C. 充电时,钛电极与外电源的负极相连
D. 放电时,进入贮罐的液体发生的离子反应方程式为:S2O82-+Fe2+=Fe3++2SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。

下列说法不正确的是
A. Fe3+对该反应有催化作用
B. 该过程中的Fe3+可由Fe(NO3)3提供
C. 可用K3[Fe(CN)6]溶液区分Fe3+与Fe2+
D. 制备CuCl2的总反应为2Cu + O2 + 4HCl = 2CuCl2 + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com