
【题目】新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于新能源的是( )
①太阳能 ②天然气 ③地热能④煤 ⑤生物质能⑥石油 ⑦风能 ⑧氢能.
A.①②③⑦⑧
B.①③⑤⑦⑧
C.①③⑤⑧
D.②④⑤⑥⑦
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是冶炼铜及制备铁氧化物的重要矿藏,常含微量的金、银等.右图是以黄铜矿为主要原料生产铜、铁红(氧化铁)颜料的工艺流程图: 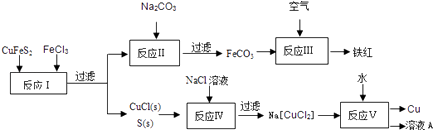
(1)CuFeS2中,Fe的化合价为 .
(2)写出“反应Ⅰ”的离子方程式 , 该反应的氧化剂是 .
(3)CuCl难溶于水,但可与过量的Cl﹣反应生成溶于水的[CuCl2]﹣ . 该反应的离子方程式为 .
(4)反应Ⅰ~V五个反应中属于非氧化还原反应的是反应(选填“Ⅰ~V”).
(5)已知Cu+在反应V中发生自身氧化还原反应,歧化为C u2+和Cu,由此可推知“溶液A”中的溶质为(写出化学式).
(6)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为
(7)将一定量的铁红溶于160mL 5molL﹣1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+ , 则参加反应的铁粉的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出方程式.
(1)碳酸氢铵溶液中加入过NaOH溶液,并加热(写出离子方量程式) .
(2)已知4℃时四种化合物在水中和液氨中的溶解度如表:
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
H2O (液) | 170g | 9.2g | 1.5×10﹣4g | 33.3g |
NH3(液) | 86g | 97.2g | 0.8g | 0g |
上述四种物质在水中形成复分解反应的离子方程式为 , 在液氨中发生复分解反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a、b、c、d均为铂电极,供选择的电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH | Cu(N O3)2 | KCl | Na2SO4 |
乙槽 | CuSO4 | NaCl | AgNO3 | NaNO3 |
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等.则应选用的电解液是( )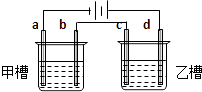
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组设计了如图1装置证明和比较SO2和氯水的漂白性,其中A装置分液漏斗中为70%的硫酸,烧瓶中为亚硫酸钠固体,B、D中为品红溶液,C中为NaOH溶液. 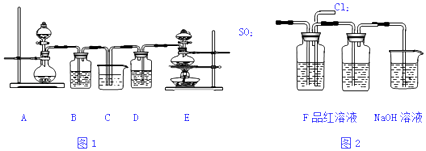
(1)实验时用装置A制备SO2气体,写出反应的化学方程式
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,取B、D溶液于试管中分别加热,两个试管中的现象分别为:BD . 解释B中对应现象的原因 .
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按如图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①两同学在气体进入品红溶液之前,先将气体通过F装置,F中可盛装浓硫酸.其目的是使SO2和Cl2混合均匀并且 .
②试分析甲同学实验过程中,品红溶液不褪色的原因是:(用离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏伽德罗常数,下列说法中正确的是( )
A.58.5 g氯化钠固体中含有NA个氯化钠分子.
B.1 mol Fe参与反应失去电子数目一定为2NA
C.1 molNa被完全氧化生成Na2O2 , 失去2NA个电子
D.常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com