
����Ŀ����ͭ��CuFeS2����ұ��ͭ���Ʊ������������Ҫ��أ��������Ľ����ȣ���ͼ���Ի�ͭ��Ϊ��Ҫԭ������ͭ�����죨�����������ϵĹ�������ͼ�� 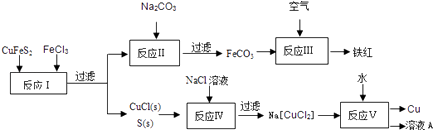
��1��CuFeS2�У�Fe�Ļ��ϼ�Ϊ ��
��2��д������Ӧ�����ӷ���ʽ �� �÷�Ӧ���������� ��
��3��CuCl������ˮ�������������Cl����Ӧ��������ˮ��[CuCl2]�� �� �÷�Ӧ�����ӷ���ʽΪ ��
��4����Ӧ��V�����Ӧ�����ڷ�������ԭ��Ӧ���Ƿ�Ӧ��ѡ���V������
��5����֪Cu+�ڷ�ӦV�з�������������ԭ��Ӧ���绯ΪC u2+��Cu���ɴ˿���֪����ҺA���е�����Ϊ��д����ѧʽ����
��6�������ԡ����������£�һ�ֽ�Thibacillus ferroxidans��ϸ���ܽ���ͭ��ת���������Σ��ù��̷�Ӧ�����ӷ���ʽΪ
��7����һ��������������160mL 5molL��1�����У��ټ����������ۣ�����Ӧ�������ռ�������2.24L����״�������������Һ����Fe3+ �� ��μӷ�Ӧ�����۵�����Ϊ ��
���𰸡�
��1��+2
��2��CuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S����CuFeS2��FeCl3
��3��Cl��+CuCl=[CuCl2]��
��4��II��I
��5��CuCl2��NaCl
��6��4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42��+2H2O
��7��11.2g
���������⣺�Ȼ������������ԣ���������ͭ���ݲ���֪��ӦIΪCuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S����Ȼ����˵õ�����CuCl��S����Һ������Һ�м���̼���Ʒ�����ӦII�����������ӷ�Ӧ����ʽΪFe2++CO32��=FeCO3�������˵õ�FeCO3 �� �ڿ���������FeCO3�õ�����������ӦIIIΪ4FeCO3+O2 ![]() 2Fe2O3+4CO2����CuCl��S�Ļ�����м���NaCl��Һ��������ӦIVΪCl��+CuCl=[CuCl2]�� �� ���˵õ�Na[CuCl2]���ټ���ˮ������ӦV����Cu����ҺA��Cu+�ڷ�ӦV�з�������������ԭ��Ӧ���绯ΪC u2+��Cu����AΪCuCl2��NaCl����1��CuFeS2��SΪ��2�ۡ�CuΪ+2�ۣ�Fe�Ļ��ϼ�Ϊ+2�ۣ����Դ��ǣ�+2����2����ӦI�����ӷ���ʽΪCuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S�����÷�Ӧ��FeCl3��CuFeS2���õ��ӣ�����CuFeS2��FeCl3������������
2Fe2O3+4CO2����CuCl��S�Ļ�����м���NaCl��Һ��������ӦIVΪCl��+CuCl=[CuCl2]�� �� ���˵õ�Na[CuCl2]���ټ���ˮ������ӦV����Cu����ҺA��Cu+�ڷ�ӦV�з�������������ԭ��Ӧ���绯ΪC u2+��Cu����AΪCuCl2��NaCl����1��CuFeS2��SΪ��2�ۡ�CuΪ+2�ۣ�Fe�Ļ��ϼ�Ϊ+2�ۣ����Դ��ǣ�+2����2����ӦI�����ӷ���ʽΪCuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S�����÷�Ӧ��FeCl3��CuFeS2���õ��ӣ�����CuFeS2��FeCl3������������
���Դ��ǣ�CuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S����CuFeS2��FeCl3����3���÷�Ӧ���ӷ���ʽΪCl��+CuCl=[CuCl2]�� �� ���Դ��ǣ�Cl��+CuCl=[CuCl2]������4����Щ��Ӧ��ֻ��II��IVΪ��������ԭ��Ӧ�����Դ��ǣ�������5����Ӧ��ΪNa[CuCl2]��H2O�ķ�Ӧ�����������Ϣ֪��������Cu��NaCl��CuCl2 �� ���õ���Һ�е�������CuCl2��NaCl�����Դ��ǣ�CuCl2��NaCl����6����������Һ�������������Խ���ͭ�������������Σ���Ӧ������μӷ�Ӧ������������ͭ����������ˮ����Ӧ�ķ���ʽΪ4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2��SO4��3+2H2O�����ӷ�Ӧ����ʽΪ��4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42��+2H2O��
���Դ��ǣ�4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42��+2H2O����7�����������ʵ���Ϊ ![]() =0.1mol��
=0.1mol��
Fe��������2HCl������H2 ��
0.1mol 0.2mol 0.1mol
������ԭ���غ㣬�����Ȼ��������ʵ���Ϊ ![]() ����0.16L��5mol/L��0.2mol��=0.2mol��
����0.16L��5mol/L��0.2mol��=0.2mol��
Fe������2FeCl3
0.1mol 0.2mol
���Բμӷ�Ӧ�����۵�����Ϊ��0.1mol+0.1mol����56g/mol=11.2g��
���Դ��ǣ�11.2g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǵĽṹ��ʽΪCH2OH��CHOH��CHOH��CHOH��CHOH��CHO�����й��������ǵ�˵���������(����)
A. �������ǵ���B. ����5���ǻ�(��OH)
C. ����1��ȩ��(��CHO)D. ����1���Ȼ�(��COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ֹ�������Ŵ�����������Ǯ�Ҽ�װ�������ִ��ڵ�غ��������ĵ��������й㷺Ӧ�á��ش��������⡣
��1���ô���������������ڣ�ʧȥ����ɫ�Ĺ���ԭ������
��2����֪,Ksp=(AgCl)=1.8��10-10 �� ����50mL0.018mol/L��AgNO3��Һ�м���50mL0.020mol/L�����ᣬ��Ϻ���Һ�е�Ag+��Ũ��Ϊ mol/L��pHΪ ��
��3��AgNO3��Һ�����ֽ⣬����Ag�ͺ���ɫ��������ʣ�����շֽ�Ļ�ѧ����ʽΪ ��
��4����ͼ��ʾԭ��������ķ�ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH��ͬ�Ĵ�����Һ�����ᣬ�ֱ�������ˮϡ�͵�ԭ�������m����n����ϡ�ͺ�����Һ��pH����ͬ����m��n�Ĺ�ϵ�� (����)
A. m<n B. m��n C. m>n D. ����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭƬ����Ƭ��Cu��NO3��2��Һ��AgNO3��Һ�����ߺ����ţ�װ����֬��KNO3��U�ιܣ�����һ��ԭ��أ���ͼ���������йظ�ԭ��ص�������ȷ����
�������·�У�������ͭ�缫�������缫
��������ӦΪ��Ag++e��=Ag
��ʵ�������ȡ�����ţ�ԭ����Լ�������
�ܽ�ͭƬ����AgNO3��Һ�з����Ļ�ѧ��Ӧ���ԭ��ط�Ӧ��ͬ�� ��
A.�٢�
B.�٢ڢ�
C.�ڢ�
D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ʱȽϣ���ȷ����(����)
A. ���ԣ�H2SO4��HClO4��HBrO4 B. ���ԣ�NaOH��KOH��RbOH
C. �ǽ����ԣ� P��S��Cl D. ��̬�⻯���ȶ��ԣ�HF��H2O��PH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����Ӧʾ��ͼ�Ĺ�ϵ��ȷ���ǣ� ��
A | B | C | D |
NaAlO2��Һ����εμ����������� | AlCl3��Һ����εμӰ�ˮ������ | ������Һ����εμ�Ba��OH��2��Һ������ | ����ʯ��ˮ�л���ͨ��CO2������ |
|
|
|
|
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̽�ն�Ա�������ᣬ��С���߽��˻�ѧ�Թ�����֪�����߳�������Ϊ�Թ������ࡰ���˵�Ұ�ޡ������������ᷴӦ�����ʻ�����ˮ��Һ�����������ܿ����ǣ��������ͨ����
��1�����ܡ��Ե�������Ļ�ѧ��Ӧ�У���������кͷ�Ӧ������������������ԭ��Ӧ�������������ܡ��Ե���������������ѧʽ����д���÷�Ӧ�����ӷ���ʽ ��
��2���ڲ��������ᷴӦ�������У����ڵ���ʵ�������д������ţ���ͬ�������ڷǵ���ʵ��� ��
��3������������߳��Թ�����ͼ������ǰ���������������ʾ���ߵ�·�ߣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Դ���ص�����Դ�ḻ����ʹ��ʱ�Ի�������Ⱦ����Ⱦ��С���ҿ���������������������Դ���ǣ� ��
��̫���� ����Ȼ�� �۵����ܢ�ú ���������ܢ�ʯ�� �߷��� �����ܣ�
A.�٢ڢۢߢ�
B.�٢ۢݢߢ�
C.�٢ۢݢ�
D.�ڢܢݢޢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com