
【题目】葡萄糖的结构简式为CH2OH—CHOH—CHOH—CHOH—CHOH—CHO,下列关于葡萄糖的说法错误的是( )
A. 葡萄糖是单糖B. 含有5个羟基(—OH)
C. 含有1个醛基(—CHO)D. 含有1个羧基(—COOH)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃,将0.4mol/L CH3COOH 溶液和 0.2mol/L NaOH 溶液各 100mL 混合后,pH=5,(设混合后溶液总体积为两溶液体积之和)
(1)混合溶液中离子浓度由大到小的顺序是
(2)①c(CH3COO﹣)+c(CH3COOH)= mol/L②c(CH3COO﹣)﹣c(CH3COOH)= mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1molL﹣1的HA溶液中c(H+)/c(OH﹣)=1010 . 请回答下列问题:
①HA是 (填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是 (填字母).
A.c(H+)/c(HA) B.c(HA)/(A﹣) C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
③若M溶液是由上述HA溶液V1mL与pH=12的NaOH溶液V2mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+)+c(OH﹣)=2.0×10﹣7 molL﹣1
B.若V1=V2 , 则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键和离子化合物的说法中正确的是( )
A.熔化状态下能够导电的物质,一定是离子化合物
B.离子化合物必由非金属元素和金属元素共同组成
C.离子化合物一定易溶于水
D.含有离子键的化合物一定是离子化合物,若形成晶体,必为离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;V、VI是气体收集装置,根据要求回求答下列问题: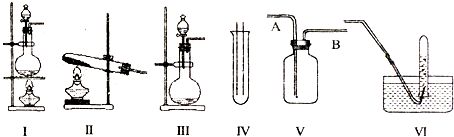
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2 , 则可选择;(填序号)若用I装置制取氯气,则浓盐酸应盛放在(填I中的仪器名称).写出实验室制取氯气的化学方程式 .
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从口通入.用化学方法检验氯气收集满的方法是 .
(3)实验室制取氯气,多余的氯气要进行尾气处理,一般将尾气通入到溶液中,其发生反应的化学方程式为 .
(4)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3 , 则所得溶液中溶质的物质的量浓度为mol/L.(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )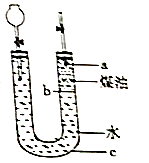
A.打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处
B.开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升,进入长颈漏斗,a处有无色气体产生
D.若用苯或酒精来代替煤油,可观察到相同的实验现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)容量瓶上含有下列量中的(填写字母) .
A.压强
B.温度
C.容积
D.密度
E.刻度线
(2)用浓硫酸配制250mL2molL﹣1硫酸溶液时,所需的玻璃仪器除烧杯、玻璃棒和胶头滴管之外,还需要(填仪器名称);在下列配制过程示意图中,有错误的是(填写序号) . 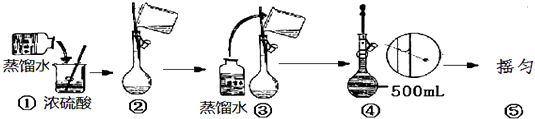
(3)现要用容量瓶配制500mL 0.4molL﹣1 Na2CO3溶液,配好的溶液倒入试剂瓶后需要贴上标签.请你帮助把如图标签上的内容填上去.
(4)下列情况将使配制溶液的物质的量浓度偏低的有(填序号).
A.容量瓶用蒸馏水洗净后,未待干燥便用来配制
B.NaOH溶解后趁热移入容量瓶中
C.定容时,俯视刻度线
D.摇匀后发现液面未到刻度线,继续加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是冶炼铜及制备铁氧化物的重要矿藏,常含微量的金、银等.右图是以黄铜矿为主要原料生产铜、铁红(氧化铁)颜料的工艺流程图: 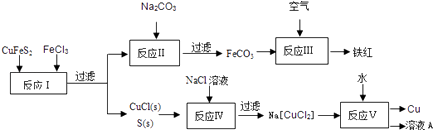
(1)CuFeS2中,Fe的化合价为 .
(2)写出“反应Ⅰ”的离子方程式 , 该反应的氧化剂是 .
(3)CuCl难溶于水,但可与过量的Cl﹣反应生成溶于水的[CuCl2]﹣ . 该反应的离子方程式为 .
(4)反应Ⅰ~V五个反应中属于非氧化还原反应的是反应(选填“Ⅰ~V”).
(5)已知Cu+在反应V中发生自身氧化还原反应,歧化为C u2+和Cu,由此可推知“溶液A”中的溶质为(写出化学式).
(6)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为
(7)将一定量的铁红溶于160mL 5molL﹣1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+ , 则参加反应的铁粉的质量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com