
【题目】锂/氟化碳电池稳定性很高。电解质为LiClO4的乙二醇二甲醚溶液,总反应为xLi+CFx=xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是

A.正极的电极反应式为CFx+xe-+xLi+=xLiF+C
B.交换膜为阴离子交换膜
C.电解质溶液可用LiClO4的乙醇溶液代替
D.b极电势高于a极电势
【答案】AD
【解析】
根据电极总反应:xLi+CFx=xLiF+C,锂作负极,电极反应为xLi-xe-= xLi+,正极是石墨棒,电极反应式为CFx+xe-+xLi+=xLiF+C,锂离子从负极移向正极,电子的移动方向从负极移向正极,由此分析。
A.根据分析,正极的电极反应式为CFx+xe-+xLi+=xLiF+C,故A正确;
B.锂离子从负极移向正极,交换膜为阳离子交换膜,故B错误;
C.乙醇和锂会发生反应,消耗锂,产生氢气,造成电极的损耗和危险,故不能使用LiClO4的乙醇溶液代替LiClO4的乙二醇二甲醚溶液,故C错误;
D.原电池中,电子从负极经导线流向正极,即由低电势流向高电势,b极电势高于a极电势,故D正确;
答案选AD。


科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的F2和ClF混合,在密闭容器中发生反应:F2(g)+ClF(g)![]() ClF3(g) ΔH<0。下列叙述正确的是
ClF3(g) ΔH<0。下列叙述正确的是
A.保持恒容,平衡后再降低温度,平衡常数减小
B.若增加F2的用量,平衡正向移动,则反应物的转化率均增大
C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移
D.恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe + CuSO4 = FeSO4+ Cu
B. AgNO3+ NaCl= AgCl↓ + NaNO3
C. MnO2 + 4 HCl(浓) ![]() MnCl2+ Cl2↑ + 2 H2O
MnCl2+ Cl2↑ + 2 H2O
D. 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所需实验装置如图所示:
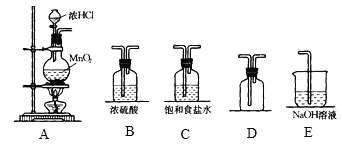
(1)写出装置A中装浓盐酸的仪器名称:______,装置A中发生反应的化学方程式:___________________。
(2)连接上述仪器,仪器的正确连接顺序是___________。
(3)NaOH溶液的作用是_________。
(4)将干燥的Cl2依次通过干燥的有色布条、湿润的有色布条,可观察到的现象是___________,得出的结论是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、3molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是
A. v甲=v丙 B. c乙< c丙 C. a甲 +a乙<1 D. K乙≤K丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为________。
的中子数为________。
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________PH3(填“>”或“<”)。沸点:N2H4________P2H4(填“>”或“<”),判断依据是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国不少古诗词清晰描述了当时人们的生活和社会的发展,如刘禹锡的《浪淘沙》“日照澄洲江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识认知正确的是
A.雾的分散质粒子直径范围是1~100nmB.淘金原理与化学上的萃取一致
C.沙子的主要成分是![]() D.“沙中浪底来”指的是金的氧化物
D.“沙中浪底来”指的是金的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属的冶炼方法有很多,有加热法,热还原法、 电解法、湿法冶金等:我国古代利用铁和硫酸铜溶液反应炼铜,属于___(填冶炼的方法);铝热反应是铝与一些金属氧化物在高温下反应,属于___(填冶炼的方法);写出铝与四氧化三铁的反应方程式:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com