
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为________。
的中子数为________。
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________PH3(填“>”或“<”)。沸点:N2H4________P2H4(填“>”或“<”),判断依据是____________。
【答案】第四周期ⅤA族 173 黑磷 > > N2H4分子间存在氢键
【解析】
(1)As位于第四周期第VA族,中子数=质量数-质子数;能量越低越稳定;
(2)元素的非金属性越强,其氢化物越稳定;分子晶体熔沸点与分子间作用力和氢键有关,能形成分子间氢键的氢化物熔沸点较高。
(1)As位于第四周期第VA族,中子数=质量数-质子数=288-115=173;
能量越低越稳定,
P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1①
P(s,白磷)=P(s,红磷)ΔH=-17.6 kJ·mol-1②
将方程式①-②得![]() ,
,
则能量:红磷>黑磷,则黑磷稳定,
故答案为:第四周期第VA族;173;黑磷;
(2)元素的非金属性越强,其氢化物越稳定;
非金属性N>P,所以热稳定性:NH3>PH3;
N2H4能形成分子间氢键、P2H4分子间不能形成氢键,所以沸点:N2H4>P2H4,
故答案为:>;>;N2H4分子间存在氢键。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮氧化物是目前的主要空气污染物之一,它的转化和综合利用既有利于节约资源,又有利于保护环境。
(1)![]() 的消除。可以用碳酸钠溶液来进行吸收,在产生
的消除。可以用碳酸钠溶液来进行吸收,在产生![]() 的同时,会生成
的同时,会生成![]() ,
,![]() 是工业盐的主要成分,在漂白、电镀等方面应用广泛。
是工业盐的主要成分,在漂白、电镀等方面应用广泛。
①写出碳酸钠溶液消除![]() 的化学方程式:________________。
的化学方程式:________________。
②写出两种能提高![]() 消除率的措施:________________。
消除率的措施:________________。
③经过一系列后续操作可以得到产品![]() ,但一般会混有一定量________的杂质。
,但一般会混有一定量________的杂质。
(2)![]() 的消除。空气中
的消除。空气中![]() 主要来自于汽车尾气的排放和硝酸工厂废气的排放,利用强氧化剂过硫酸钠(
主要来自于汽车尾气的排放和硝酸工厂废气的排放,利用强氧化剂过硫酸钠(![]() )氧化脱除
)氧化脱除![]() 可以消除污染,其流程如下:
可以消除污染,其流程如下:

①反应1的离子方程式为________________。
②反应2中![]() 的初始浓度为
的初始浓度为![]() ,反应为
,反应为![]() 。不同温度下,达到平衡时
。不同温度下,达到平衡时![]() 的脱除率与过硫酸钠(
的脱除率与过硫酸钠(![]() )初始浓度的关系如下图所示。
)初始浓度的关系如下图所示。

图中点a和点b的平衡常数K的大小关系为________________。判断依据是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料在疫情防控和治疗中起到了重要的作用。下列说法正确的是
A.聚乙烯是生产隔离衣的主要材料,能使酸性高锰酸钾溶液褪色
B.聚丙烯酸树脂是3D打印护目镜镜框材料的成分之一,可以与NaOH溶液反应
C.天然橡胶是制作医用无菌橡胶手套的原料,它是异戊二烯发生缩聚反应的产物
D.聚乙二醇可用于制备治疗新冠病毒的药物,聚乙二醇的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂/氟化碳电池稳定性很高。电解质为LiClO4的乙二醇二甲醚溶液,总反应为xLi+CFx=xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是

A.正极的电极反应式为CFx+xe-+xLi+=xLiF+C
B.交换膜为阴离子交换膜
C.电解质溶液可用LiClO4的乙醇溶液代替
D.b极电势高于a极电势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2===2Cl﹣+2Fe3+,2Br﹣+Cl2===Br2+2Cl﹣,2Fe2++Br2===2Br﹣+2Fe3+。含有amol FeBr2的溶液中,通入xmol Cl2,下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A. x=0.4a,2Fe2++Cl2===2Fe3++2Cl﹣
B. x=0.6a,2Br﹣+Cl2===Br2+2Cl﹣
C. x=a,2Fe2++2Br﹣+2Cl2===Br2+2Fe3++4Cl﹣
D. x=1.5a,2Fe2++4Br﹣+3Cl2===2Br2+2Fe3++6Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现往体积固定的密闭容器中通入等物质的量的NO2和CO,反应中的CO和NO的浓度随时间变化的示意图如图。根据图意回答下列问题:
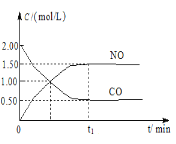
(1)从反应开始到平衡,用NO2浓度变化表示平均反应速率υ(NO2)=___。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答:
CO2(g)+H2(g)△H<0。试回答:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态___(填“是”与“否”),此时υ(正)__υ(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
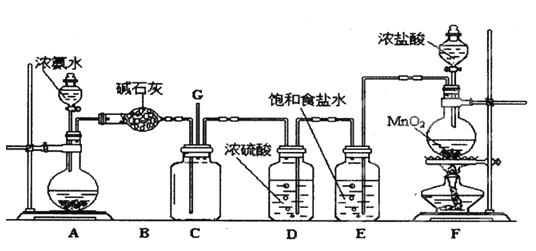
请回答下列问题:
(1)装置F中发生反应的化学方程式为____________________________.
(2)装置B中仪器的名称是___________;装置E的作用是______________________.
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式___________________________________.
(4)装置C内当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为_______mol-1(用含a、b的代数式表示)。
(5)将用F、E、D装置制得的氯气通人含74gCa(OH)2的石灰乳中,最多可制得漂白粉_______g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com