
【题目】现往体积固定的密闭容器中通入等物质的量的NO2和CO,反应中的CO和NO的浓度随时间变化的示意图如图。根据图意回答下列问题:
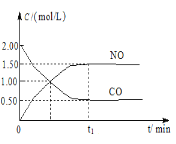
(1)从反应开始到平衡,用NO2浓度变化表示平均反应速率υ(NO2)=___。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答:
CO2(g)+H2(g)△H<0。试回答:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态___(填“是”与“否”),此时υ(正)__υ(逆)(填“大于”“小于”或“等于”)。
【答案】![]() 1 否 大于
1 否 大于
【解析】
(1)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,根据υ=![]() 计算υ(NO),再利用速率之比等于化学计量数之比计算υ(NO2);
计算υ(NO),再利用速率之比等于化学计量数之比计算υ(NO2);
(2)①根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
②计算瞬时的浓度商Qc,与平衡常数比较判断反应进行方向,据此解答;
(1)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,故υ(NO)=![]() ,因化学反应速率之比等于化学计量数之比,故υ(NO2)=υ(NO)=
,因化学反应速率之比等于化学计量数之比,故υ(NO2)=υ(NO)=![]() ;故答案为:
;故答案为:![]() 。
。
(2)①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始(mol/L):2 3 0 0
变化(mol/L):2×60% 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
反应的平衡常数K=![]() =1;故答案为:1。
=1;故答案为:1。
②在相同温度下,若起始时c(CO)=1molL-1,c(H2O)=2molL-1,反应进行一段时间后,测得H2的浓度为0.5molL-1,则:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始(mol/L):1 2 0 0
变化(mol/L):0.5 0.5 0.5 0.5
末态(mol/L):0.5 1.5 0.5 0.5
浓度商Qc=![]() <1,故反应正向进行,此时υ(正)>υ(逆);
<1,故反应正向进行,此时υ(正)>υ(逆);
故答案为:否;大于。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
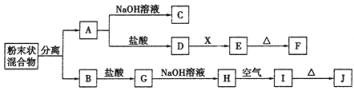
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所需实验装置如图所示:
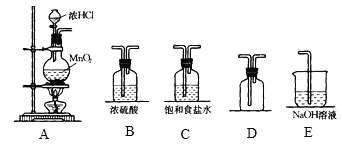
(1)写出装置A中装浓盐酸的仪器名称:______,装置A中发生反应的化学方程式:___________________。
(2)连接上述仪器,仪器的正确连接顺序是___________。
(3)NaOH溶液的作用是_________。
(4)将干燥的Cl2依次通过干燥的有色布条、湿润的有色布条,可观察到的现象是___________,得出的结论是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为________。
的中子数为________。
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________PH3(填“>”或“<”)。沸点:N2H4________P2H4(填“>”或“<”),判断依据是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。取20.00mL待测盐酸放入锥形瓶中,滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是____
②根据上述数据,可计算出该盐酸的浓度约为___。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有____。(双选)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是___
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国不少古诗词清晰描述了当时人们的生活和社会的发展,如刘禹锡的《浪淘沙》“日照澄洲江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识认知正确的是
A.雾的分散质粒子直径范围是1~100nmB.淘金原理与化学上的萃取一致
C.沙子的主要成分是![]() D.“沙中浪底来”指的是金的氧化物
D.“沙中浪底来”指的是金的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰) ![]() Sn(s、白) △H3=+2.1kJ/mol
Sn(s、白) △H3=+2.1kJ/mol
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
D.灰锡转化为白锡的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
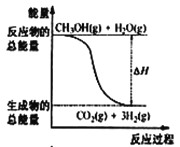
①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H=+49. 0 kJ·mol-1
②CH3OH(g)+![]() O2(g) = CO2(g)+2H2(g) △H=-192. 9 kJ·mol-1
O2(g) = CO2(g)+2H2(g) △H=-192. 9 kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.根据②推知反应:CH3OH(l) +![]() O2(g) =CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) =CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
C.CH3OH转变成H2的过程一定要吸收能量
D.反应①中的能量变化如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 ,下列说法正确的是
,下列说法正确的是
A.该物质可由两种单体分子之间通过加聚反应生成
B.该物质的有机物单体,不能使FeCl3溶液显紫色
C.0.1 mol单体(有机物)与足量Na反应,生成2.24 L H2(标准状况)
D.1 mol该物质与足量NaOH溶液反应,最多可消耗2n mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com