
【题目】手机芯片的主要成分是
A. Si B. SiC C. SiO2 D. Na2SiO3
科目:高中化学 来源: 题型:
【题目】(1)元素的第一电离能:N________O(填“>”或“<”)。
(2)基态Fe2+的电子排布式为___________________________。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
In/kJ·mol-1 | 578 | 1 817 | 2 745 | 11 575 | … |
则该元素的元素符号是________。
(4)NO![]() 的空间构型_____________________(用文字描述),SO
的空间构型_____________________(用文字描述),SO![]() 中硫原子的杂化方式为________________________。
中硫原子的杂化方式为________________________。
(5)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是_______________________。
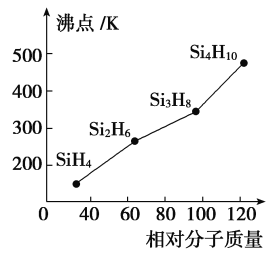
(6)金属铜原子的堆积方式为面心立方最密堆积,铜的原子半径为r nm,则铜晶胞的体积表达式为________ cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的核外电子排布式为_____________________。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是________(用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是______________________________。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为___________________________。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为________。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为_______________________________。
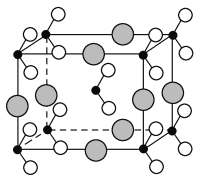
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
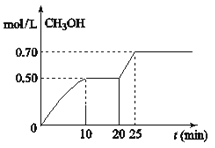
A.从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B.从20分钟到25分钟达到新的平衡,可能是增大压强
C.其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D.从开始到25分钟,CO2的转化率是70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列有关CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 同温同压下,气体的物质的量与体积成反比。
B. 同温同体积时,气体的物质的量与压强成反比。
C. 同温同物质的量时,气体的压强与体积成正比。
D. 同压同体积时,气体的物质的量与温度成反比。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com