
【题目】轧钢厂排出的废水主要含有盐酸,通常采用的处理方法是
A. 中和法 B. 过滤法
C. 氧化还原法 D. 化学沉淀法
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1mol O的质量是16gmol﹣1
B.1mol CO2的质量是44 gmol﹣1
C.氢的摩尔质量是2 gmol﹣1
D.Na+的摩尔质量是23 gmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2+、Fe3+与O![]() 、CN-、F-有机分子等形成的化合物具有广泛的应用。
、CN-、F-有机分子等形成的化合物具有广泛的应用。
(1)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(2)Fe2+基态核外电子排布式为__________________________。
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。
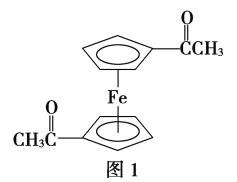
此物质中碳原子的杂化方式是______________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为___________________________。
(5)F-不仅可与Fe3+形成[FeF6]3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。
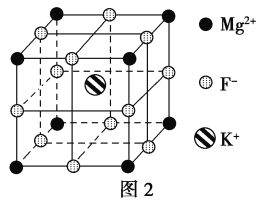
该晶体的化学式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,等体积混合0.1mol/L的HCl溶液和0.06mol/L的Ba(OH)2溶液后,溶液的pH值等于( )
A.2.0 B.12.3 C.1.7 D.12.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.正反应是放热反应的可逆反应,升高温度v(正)>v(逆)
B.加压可使速率加快,是因为增加活化分子百分数而使反应速率加快
C.活化分子的碰撞不一定都能发生化学反应
D.催化剂可改变反应进程,故加催化剂改变了一个反应的 △H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
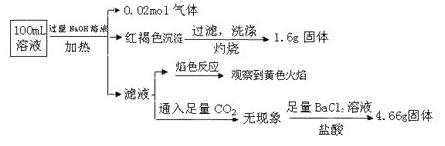
下列说法正确的是( )
A. 原溶液中c(Fe3+)=0.2 molL-1
B. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
C. SO42ˉ、NH4+、Na+一定存在,CO32ˉ一定不存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末样品中可能含有SiO2、Fe2O3、CaO、CuO、MgO、Na2O和炭粉等成分,为确认其中的组分,某同学设计并完成了如下实验:
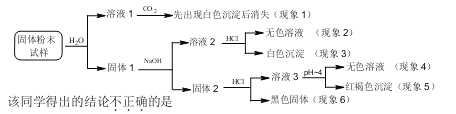
A.从现象1和3可推断样品中有CaO,没有Na2O
B.从现象3可推断样品中有SiO2
C.从现象4和5可推断样品中有Fe2O3和MgO
D.从现象4和6可推断样品中有炭粉,无CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是
A.增大反应物的浓度,活化分子百分数增加,反应速率加快
B.增大气体反应体系的压强,单位体积中活化分子数增多,气体反应速率加快
C.升高反应的温度,活化分子百分数增加,有效碰撞的几率提高,反应速率增大
D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com