
【题目】氨是化肥工业和基本有机化工的主要原料,工业采用N2和H2合成氨的催化过程如下图所示。已知合成氨的反应为放热反应,下列说法正确的是
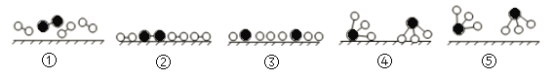
A.使用催化剂可改变反应的△H
B.过程③到④形成N—H吸收能量
C.升高温度,合成氨反应的平衡常数减小
D.催化剂可有效提高反应物的平衡转化率
科目:高中化学 来源: 题型:
【题目】在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法不正确的是( )
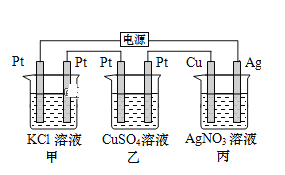
A.标准状况下当甲中产生4.48L气体时,丙中Cu电极质量增加21.6g
B.电解过程中丙中溶液pH无变化
C.向甲中加入适量的盐酸,可使溶液恢复到电解前的状态
D.乙中左侧电极反应式:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的KBrO3固体配制一定体积的a mol·L1 KBrO3标准溶液;
Ⅱ.取v1 mL上述溶液,加入过量KBr,加HSO4酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入v2 mL废水;
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用b mol·L1 Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液v2 mL。
已知:I2+2Na2S2O3=2NaI+ Na2S4O6
Na2S2O3和Na2S4O6溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和____________。
(2)Ⅰ中发生反应的离子方程式是_______________________________。
(3)Ⅲ中发生反应的化学方程式是_________________________________。
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是______________________________。
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是________。
(6)Ⅴ中滴定至终点的现象是_____________________________。
(7)废水中苯酚的含量为___________g·L1(苯酚摩尔质量:94 g·mol 1)。
(8)由于Br2具有____________性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L- 1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示。

(1)原HA中水电离出的c(H+)=________mol·L-1
(2)与曲线I上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解Na2CO3溶液可制取NaHCO3溶液和NaOH溶液,原理如下图所示。下列说法不正确的是

A.b极为阴极,产生的气体A为H2
B.溶液中的Na+通过交换膜由b极室到a极室
C.B可以使用稀NaOH溶液,其效果优于纯水
D.a极电极反应为4CO32-+2H2O-4e-=4HCO3-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:

相关反应的热化学方程式为:
反应I:SO2(g) + I2(g) + 2H2O(l) === 2HI(aq) + H2SO4(aq) ΔH1 =﹣213 kJ·mol-1
反应II:H2SO4(aq) === SO2(g) + H2O(l) + ![]() O2(g) ΔH2 = +327 kJ·mol-1
O2(g) ΔH2 = +327 kJ·mol-1
反应III:2HI(aq) === H2(g) + I2(g) ΔH3 = +172 kJ·mol-1
下列说法不正确的是:
A. 该过程实现了太阳能到化学能的转化
B. SO2和I2对总反应起到了催化剂的作用
C. 总反应的热化学方程式为:2H2O(l) === 2H2 (g)+O2(g) ΔH = +286 kJ·mol-1
D. 该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组想在实验室收集一瓶干燥纯净的氯气,其实验装置及药品如下。

(1)饱和NaCl的作用是________。
(2)氢氧化钠溶液吸收氯气的离子方程式为________。
(3)已知:不同温度下MnO2与盐酸反应的平衡常数
温度t/℃ | 50 | 80 | 110 |
平衡常数K | 3.104×10-4 | 2.347×10-3 | 1.293×10-2 |
MnO2与盐酸的反应是________(填“放热”或“吸热”)。
(4) 实验采用4 mol/L盐酸时,没有产生明显实验现象。小组学生猜测可能是反应速率慢,其原因可能是:________
Ⅰ 反应温度低;Ⅱ盐酸浓度低。
为探究条件对反应速率的影响,小组同学设计并完成以下实验:
序号 | 试剂 | 条件 | 现象 |
实验1 | 4 mol/L盐酸、MnO2 | 加热 | 无明显现象 |
实验2 | 7 mol/L浓盐酸、MnO2 | 不加热 | 无明显现象 |
实验3 | 7 mol/L浓盐酸、MnO2 | 加热 | 产生黄绿色气体 |
① 根据上述实验可知MnO2与盐酸反应产生氯气的条件为________。
② 小组学生进一步猜测:
Ⅰ.盐酸中c(H+)大小影响了反应速率。
Ⅱ.盐酸中c(Cl-) 大小影响了反应速率。
设计实验方案探究该小组学生的猜想。
③ 为探究增大H+浓度,是增强了MnO2的氧化性,还是增强了Cl-的还原性,小组同学设计了如下实验。

实验中试剂X是________。接通电路,指针几乎不发生偏转。若向右侧容器中滴加浓H2SO4,指针偏转几乎没有变化;若向左侧容器中滴加等体积浓H2SO4,指针向左偏转。则可以得到的结论是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为________;水解聚合反应会导致溶液的pH________。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×102 mol·L1 K2Cr2O7溶液滴定至终点(滴定过程中![]() 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com