
【题目】电解Na2CO3溶液可制取NaHCO3溶液和NaOH溶液,原理如下图所示。下列说法不正确的是

A.b极为阴极,产生的气体A为H2
B.溶液中的Na+通过交换膜由b极室到a极室
C.B可以使用稀NaOH溶液,其效果优于纯水
D.a极电极反应为4CO32-+2H2O-4e-=4HCO3-+O2↑
【答案】B
【解析】
遇到本题考查电解池有关的性质,首先从a极产物为O2,判断a极为阳极,b极为阴极,电解池中阳离子从阴极移向阳极、阳离子从阳极移向阴极,但是本题是阳离子交换膜,仅允许阳离子通过。
A.a极产生O2,a极发生氧化反应,a极为阳极,则b极为阴极,发生还原反应,反应式为2H2O+2e-= H2+2OH-,A正确;
B.电解池中阳离子移向阴极,溶液中的Na+通过交换膜由a极室到b极室,B错误;
C. 水是弱电解质,导电性比较弱,B可以使用稀NaOH溶液,增强溶液的导电性,C正确;
D.a极电极反应为2H2O-4e-=4H++O2↑、H++CO32-=HCO3-,总的离子方程式为:4CO32-+2H2O-4e-=4HCO3-+O2↑,D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】目前,对CO、NOx的综合利用是科学家研究的热点。回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) H2=-566kJ·mol-1
2NO(g)+O2(g)=2NO2(g) H3=-116.2kJ·mol-1
写出CO和NO2反应生成N2的热化学方程式:____。
(2)制备AlCl3的实际生产过程中,常加入足量的碳粉,反应后生成CO(g)。T℃时,向恒容密闭容器中加入3mol Al2O3(s)、8mol C(s)和3.3mol Cl2(g),发生反应。Cl2的浓度变化如图1所示;图2为20min后改变容器中条件,平衡体系的反应速率(v)随时间(t)的变化关系,且四个阶段都各改变一种不同的条件。
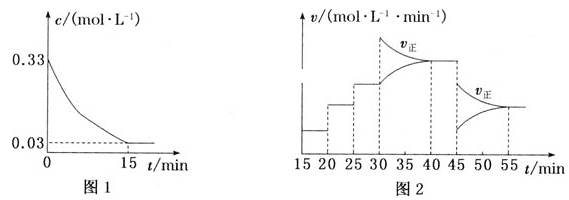
①容器中发生反应的化学方程式为___。
②0~15min内,该反应的平均速率v(CO)=___mol·L-1·min-1。
③T℃时,该反应的平衡常数K=___。
④15min时的平衡常数K(15)、44 min时的平衡常数K(44)与55min时的平衡常数K(55)的大小关系为____。
(3)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g)。一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___(填标号)。
4NO2(g)+O2(g)。一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___(填标号)。
A.容器中气体的密度不发生变化
B.NO2和O2的体积比保持不变
C.v正(NO2)=2v逆(N2O5)
D.气体的平均相对分子质量为43.2,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式_________.已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH=_____.
②泡沫灭火器中通常装有NaHCO3 溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为___________(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是_____.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:
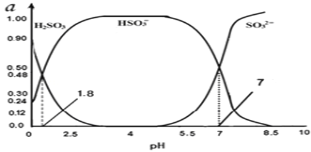
①图中pH=7时,溶液中离子浓度关系正确的是___。
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3![]() H++ HSO3﹣的平衡常数的数值____.
H++ HSO3﹣的平衡常数的数值____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化肥工业和基本有机化工的主要原料,工业采用N2和H2合成氨的催化过程如下图所示。已知合成氨的反应为放热反应,下列说法正确的是
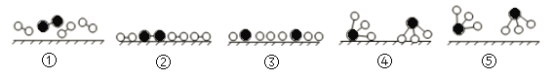
A.使用催化剂可改变反应的△H
B.过程③到④形成N—H吸收能量
C.升高温度,合成氨反应的平衡常数减小
D.催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如图装置合成正丁醛。
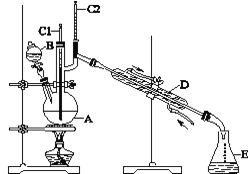
发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为_______。
(2)加入沸石的作用是_____________。若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是___________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿石是制取硫酸的主要原料,主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化)。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
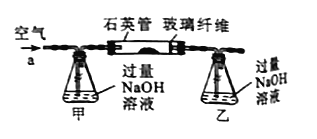
(1)鼓人空气的作用是___________,锥形瓶乙中NaOH溶液的作用是___________。
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
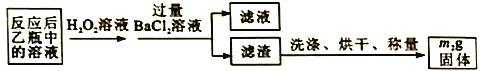
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。
(3)洗涤滤渣的方法是______________________。
(4)该黄铁矿石中硫元素的质量分数为___________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣;②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤;③将滤液稀释至250mL;④取25.00mL稀释液,用0.1000mol·L-1的酸性KMnO4溶液滴定,三次滴定实验,平均消耗酸性KMnO4溶液25.00mL。
(5)操作②中用铁粉作还原剂,测定铁的含量___________(填“偏高”或“偏低”或“不变”),操作④中滴定时酸性KMnO4溶液盛装在___________填“酸式滴定管”或“碱式滴定管”),③中稀释液中Fe2+的物质的量浓度c(Fe2+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属接触时,接触部位会发生“电偶腐蚀”。金属铁和铜在自来水和海水中,相同时间发生的腐蚀情况如图。下列有关说法正确的是( )
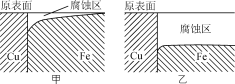
A.甲图中的介质为海水
B.腐蚀过程中电能转化为化学能
C.铁电极反应式为Fe-3e-=Fe3+
D.若在金属表面涂油漆,可以减弱铁的腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com