
ΓΨΧβΡΩΓΩNaOH»ή“ΚΩ…”Ο”ΎΕύ÷÷ΤχΧεΒΡ¥ΠάμΘ°
(1)CO2 «Έ¬ “ΤχΧεΘ§Ω…”ΟNaOH»ή“ΚΈϋ ’ΒΟΒΫNa2CO3ΜρNaHCO3Θ°
ΔΌNa2CO3ΥΉ≥Τ¥ΩΦνΘ§“ρCO32©¹Υ°ΫβΕχ ΙΤδΥ°»ή“Κ≥ Φν–‘Θ§–¥≥ωCO32©¹ΒΎ“Μ≤ΫΥ°ΫβΒΡάκΉ”ΖΫ≥Χ Ϋ_________Θ°“―÷Σ25Γφ ±Θ§CO32©¹ΒΎ“Μ≤ΫΥ°ΫβΒΡΤΫΚβ≥Θ ΐKh=2ΓΝ10©¹4mol/LΘ§Β±»ή“Κ÷–cΘ®HCO3©¹Θ©ΘΚcΘ®CO32©¹Θ©=20ΘΚ1 ±Θ§»ή“ΚΒΡpH=_____Θ°
ΔΎ≈ίΡ≠ΟπΜπΤς÷–Ά®≥ΘΉΑ”–NaHCO3 »ή“ΚΚΆAl2(SO4)3»ή“ΚΘ§«κ–¥≥ω’βΝΫ÷÷»ή“ΚΜλΚœ ±ΒΡάκΉ”Ζ¥”ΠΖΫ≥Χ Ϋ__________Θ°
(2)Ϋπ τ”κ≈®œθΥαΖ¥”Π≤ζ…ζΒΡNO2Ω…”ΟNaOH»ή“ΚΈϋ ’Θ§Ζ¥”ΠΖΫ≥Χ ΫΈΣΘΚ2NO2+2NaOH=NaNO3+NaNO2+H2OΘ°Κ§0.2molNaOHΒΡΥ°»ή“Κ”κ0.2mol NO2«ΓΚΟΆξ»ΪΖ¥”ΠΒΟ1L»ή“ΚAΘ§»ή“ΚBΈΣ0Θ°lmolL©¹1CH3COONa»ή“ΚΘ§‘ρΝΫΖί»ή“Κ÷–cΘ®NO3©¹Θ©ΓΔcΘ®NO2©¹Θ©ΚΆcΘ®CH3COO©¹Θ©”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣ___________Θ®“―÷ΣHNO2ΒΡΒγάκ≥Θ ΐKa=7.1ΓΝ10©¹4molL©¹1Θ§CH3COOHΒΡΒγάκ≥Θ ΐKa=1.7ΓΝ10©¹5molL©¹1Θ©Θ°Ω… Ι»ή“ΚAΚΆ»ή“ΚBΒΡ pHœύΒ»ΒΡΖΫΖ® «_____Θ°
AΘ°œρ»ή“ΚA÷–Φ” ΝΩNaOH BΘ°œρ»ή“ΚA÷–Φ” ΝΩΥ°
CΘ°œρ»ή“ΚB÷–Φ” ΝΩNaOH DΘ°œρ»ή“ΚB÷–Φ” ΝΩΥ°
(3)―ΧΤχ÷–ΒΡSO2Μα“ΐΤπΥα”ξΘ§Ω…άϊ”Ο«β―θΜ·ΡΤ»ή“ΚΈϋ ’ΓΘΈϋ ’SO2ΒΡΙΐώΈ÷–Θ§»ή“Κ÷–H2SO3ΓΔHSO3©¹ΓΔSO32©¹»ΐ’ΏΥυ’ΦΈο÷ ΒΡΝΩΖ÷ ΐΘ®aΘ©ΥφpH±δΜ·ΒΡΙΊœΒ»γΆΦΥυ ΨΘΚ
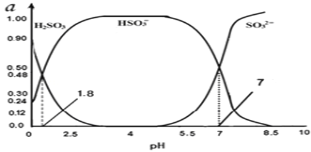
ΔΌΆΦ÷–pH=7 ±Θ§»ή“Κ÷–άκΉ”≈®Ε»ΙΊœΒ’ΐ»ΖΒΡ «___ΓΘ
AΘ°cΘ®Na+Θ©ΘΨ2cΘ®SO32©¹Θ©ΘΨcΘ®HSO3©¹Θ©
BΘ°cΘ®Na+Θ©=cΘ®SO32©¹Θ©+cΘ®HSO3©¹Θ©+cΘ®H2SO3Θ©
CΘ°cΘ®OH©¹Θ©=cΘ®H+Θ©+cΘ®H2SO3Θ©+cΘ®HSO3©¹Θ©
DΘ°cΘ®Na+Θ©ΘΨcΘ®HSO3©¹Θ©ΘΨcΘ®SO32©¹Θ©ΘΨcΘ®H+Θ©=cΘ®OH©¹Θ©
ΔΎάϊ”Ο…œΆΦ÷– ΐΨίΘ§«σΖ¥”ΠH2SO3![]() H++ HSO3©¹ΒΡΤΫΚβ≥Θ ΐΒΡ ΐ÷Β____Θ°
H++ HSO3©¹ΒΡΤΫΚβ≥Θ ΐΒΡ ΐ÷Β____Θ°
ΓΨ¥πΑΗΓΩCO32©¹+H2O ![]() HCO3©¹+OH©¹ 9 3HCO3©¹+Al3+=Al(OH)3Γΐ+3CO2Γϋ cΘ®NO3©¹Θ©ΘΨcΘ®NO2©¹Θ©ΘΨcΘ®CH3COO©¹Θ© AD A 10-1.8
HCO3©¹+OH©¹ 9 3HCO3©¹+Al3+=Al(OH)3Γΐ+3CO2Γϋ cΘ®NO3©¹Θ©ΘΨcΘ®NO2©¹Θ©ΘΨcΘ®CH3COO©¹Θ© AD A 10-1.8
ΓΨΫβΈωΓΩ
(1)ΔΌCO32-Υ°ΫβΕχ ΙΤδΥ°»ή“Κ≥ Φν–‘Θ§ΤδCO32-ΒΎ“Μ≤ΫΥ°ΫβΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚCO32-+H2OHCO3-+OH-Θ§Υ°Ϋβ≥Θ ΐKh=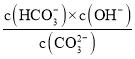 Θ§Β±»ή“Κ÷–c(HCO3-)ΘΚc(CO32-)=20ΘΚ1 ±Θ§ΗυΨίΥ°Ϋβ≥Θ ΐΦΤΥψc(OH-)Θ§”…ΗυΨίΥ°ΒΡάκΉ”ΜΐKwΦΤΥψc(H+)Θ§ΗυΨίpH=-lgc(H+)ΦΤΥψΘΜ
Θ§Β±»ή“Κ÷–c(HCO3-)ΘΚc(CO32-)=20ΘΚ1 ±Θ§ΗυΨίΥ°Ϋβ≥Θ ΐΦΤΥψc(OH-)Θ§”…ΗυΨίΥ°ΒΡάκΉ”ΜΐKwΦΤΥψc(H+)Θ§ΗυΨίpH=-lgc(H+)ΦΤΥψΘΜ
ΔΎAl2(SO4)3”κNaHCO3ΜλΚœ ±ΡήœύΜΞ¥ΌΫχΥ°Ϋβ…ζ≥…«β―θΜ·¬Ν≥ΝΒμΓΔΕΰ―θΜ·ΧΦΤχΧεΘΜ
(2)»ή“ΚA÷–NaNO3ΓΔNaNO2ΒΡ≈®Ε»ΨυΈΣ0.1mol/LΘ§HNO2ΓΔCH3COOHΨυΈΣ»θΥαΘ§”…Βγάκ≥Θ ΐΩ…÷ΣCH3COOHΥα–‘–Γ”ΎHNO2ΒΡΥα–‘Θ§»ή“Κ÷–¥ΉΥαΗυάκΉ”Υ°Ϋβ≥ΧΕ»¥σ”Ύ―«œθΥαΗυάκΉ”Υ°Ϋβ≥ΧΕ»Θ§»ή“ΚBΦν–‘¥σ”ΎA»ή“ΚΘΜ
(3)ΔΌAΘ°”…ΒγΚ… ΊΚψΩ…÷ΣΘ§c(H+)+c(Na+)®T2c(SO32-)+c(HSO3-)+c(OH-)Θ§÷––‘»ή“Κ‘ρc(H+)®Tc(OH-)Θ§‘ρc(Na+)®T2c(SO32-)+c(HSO3-)Θ§Υυ“‘c(Na+)ΘΨ2c(SO32-)Θ§”…ΆΦΩ…÷ΣpH=7 ±Θ§c(SO32-)=c(HSO3-)Θ§‘ρc(Na+)ΘΨ2c(SO32-)ΘΨc(HSO3-)Θ§Ι A ’ΐ»ΖΘΜ
BΘ°”…ΒγΚ… ΊΚψΩ…÷ΣΘ§c(H+)+c(Na+)®T2c(SO32-)+c(HSO3-)+c(OH-)Θ§÷––‘»ή“Κ‘ρc(H+)®Tc(OH-)Θ§‘ρc(Na+)®T2c(SO32-)+c(HSO3-)Θ§c(SO32-)ΓΌc(H2SO3)Θ§Ι B¥μΈσΘΜ
CΘ°pH=7 ±Θ§c(H+)=c(OH-)ΘΜ
DΘ°HSO3-Βγάκ≥ΧΕ»¥σ”ΎΥ°Ϋβ≥ΧΕ»ΒΦ÷¬»ή“Κ≥ Υα–‘Θ§“ρΈΣ―«ΝρΥα«βΗυάκΉ”Φ»ΡήΒγάκ”÷ΡήΥ°ΫβΘ§Υυ“‘»ή“Κ÷–¥φ‘ΎH2SO3ΓΔSO32-Θ§‘ΎNaHSO3»ή“Κ÷–¥φ‘ΎΒγΚ… ΊΚψΚΆΈοΝœ ΊΚψΘ§ΗυΨίΒγΚ… ΊΚψΚΆΈοΝœ ΊΚψ≈–ΕœΘΜ
ΔΎH2SO3![]() H++ HSO3©¹Θ§”…ΆΦ÷– ΐΨίΘ§pH=1.8 ±Θ§c(H2SO3 )=c(HSO3- )Θ§”…KaΒΡ±μ¥ο ΫΩ…÷ΣΘ§H2SO3ΒΡΒΎ“ΜΦΕΒγάκΤΫΚβ≥Θ ΐKa1Γ÷c(H+)=10-1.8Θ§”…¥ΥΖ÷ΈωΫβ¥πΓΘ
H++ HSO3©¹Θ§”…ΆΦ÷– ΐΨίΘ§pH=1.8 ±Θ§c(H2SO3 )=c(HSO3- )Θ§”…KaΒΡ±μ¥ο ΫΩ…÷ΣΘ§H2SO3ΒΡΒΎ“ΜΦΕΒγάκΤΫΚβ≥Θ ΐKa1Γ÷c(H+)=10-1.8Θ§”…¥ΥΖ÷ΈωΫβ¥πΓΘ
(1)ΔΌCO32©¹Υ°ΫβΕχ ΙΤδΥ°»ή“Κ≥ Φν–‘Θ§CO32©¹ΒΎ“Μ≤ΫΥ°ΫβΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚCO32©¹+H2OHCO3©¹+OH©¹Θ§Υ°Ϋβ≥Θ ΐKh=2ΓΝ10©¹4Θ§Β±»ή“Κ÷–c(HCO3-)ΘΚc(CO32©¹)=20ΘΚ1 ±Θ§c(OH©¹)=10©¹5mol/LΘ§”…Υ°ΒΡάκΉ”ΜΐKwΩ…÷ΣΘ§c(H+)=10©¹9mol/LΘ§Υυ“‘pH=©¹lg10©¹9=9ΘΜ
ΔΎAl2(SO4)3”κNaHCO3ΜλΚœ ±ΡήœύΜΞ¥ΌΫχΥ°Ϋβ…ζ≥…«β―θΜ·¬Ν≥ΝΒμΓΔΕΰ―θΜ·ΧΦΤχΧεΘ§άκΉ”ΖΫ≥Χ ΫΈΣAl3++3HCO3©¹®TAl(OH)3Γΐ+3CO2ΓϋΘΜ
(2)0.2mol NaOHΒΡΥ°»ή“Κ”κ0.2mol NO2«ΓΚΟΆξ»ΪΖ¥”ΠΒΟ1L»ή“ΚAΘ§”…2NO2+2NaOH®TNaNO3+NaNO2+H2OΘ§ΒΟΒΫ»ή“ΚA÷–NaNO3Έο÷ ΒΡΝΩ≈®Ε»ΈΣ0.1mol/LΘ§NaNO2Έο÷ ΒΡΝΩ≈®Ε»ΈΣ0.1mol/LΘ§»ή“ΚBΈΣ0.1molL©¹1ΒΡCH3COONa»ή“ΚΘΜ HN2ΒΡΒγάκ≥Θ ΐKa=7.1ΓΝ10©¹4molL©¹1Θ§CH3COOHΒΡΒγάκ≥Θ ΐKa=1.7ΓΝ10©¹5molL©¹1Θ§ΥΒΟςCH3COOHΥα–‘–Γ”ΎHNO2ΒΡΥα–‘Θ§»ή“Κ÷–¥ΉΥαΗυάκΉ”Υ°Ϋβ≥ΧΕ»¥σ”Ύ―«œθΥαΗυάκΉ”Υ°Ϋβ≥ΧΕ»Θ§»ή“ΚBΦν–‘¥σ”ΎA»ή“ΚΘ§ΝΫ»ή“Κ÷–c(NO3©¹)ΓΔc(NO2©¹)ΚΆc(CH3COO©¹)”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣc(NO3©¹)ΘΨc(NO2©¹)ΘΨc(CH3COO©¹)ΘΜ
AΘ°œρ»ή“ΚA÷–Φ” ΝΩNaOHΘ§‘ω¥σΦν–‘Θ§Ω…“‘ΒςΫΎ»ή“ΚpHœύΒ»Θ§Ι A’ΐ»ΖΘΜ
BΘ°»ή“ΚBΦν–‘¥σ”ΎA»ή“ΚΘ§œρ»ή“ΚA÷–Φ” ΝΩΥ°Θ§œΓ Ά»ή“ΚΘ§Φν–‘Φθ»θΘ§≤ΜΡήΒςΫΎ»ή“ΚpHœύΒ»Θ§Ι B¥μΈσΘΜ
CΘ°»ή“ΚBΦν–‘¥σ”ΎA»ή“ΚΘ§œρ»ή“ΚB÷–Φ” ΝΩNaOHΘ§»ή“ΚpHΗϋ¥σΘ§Ι C¥μΈσΘΜ
DΘ°œρ»ή“ΚB÷–Φ” ΝΩΥ°Θ§œΓ Ά»ή“ΚΦν–‘Φθ»θΘ§Ω…“‘ΒςΫΎ»ή“ΚpHœύΒ»Θ§Ι D’ΐ»ΖΘΜ
Ι ¥πΑΗΈΣADΘΜ
(3)ΔΌAΘ°”…ΒγΚ… ΊΚψΩ…÷ΣΘ§c(H+)+c(Na+)®T2c(SO32©¹)+c(HSO3©¹)+c(OH©¹)Θ§÷––‘»ή“Κ‘ρc(H+)®Tc(OH©¹)Θ§‘ρc(Na+)®T2c(SO32©¹)+c(HSO3©¹)Θ§Υυ“‘c(Na+)ΘΨ2c(SO32©¹)Θ§Εχ”…ΆΦΩ…÷ΣpH=7 ±Θ§c(SO32©¹)=c(HSO3©¹)Θ§‘ρc(Na+)ΘΨ2c(SO32©¹)ΘΨc(HSO3©¹)Θ§Ι A ’ΐ»ΖΘΜ
BΘ°”…ΒγΚ… ΊΚψΩ…÷ΣΘ§c(H+)+c(Na+)®T2c(SO32©¹)+c(HSO3©¹)+c(OH©¹)Θ§÷––‘»ή“Κ‘ρc(H+)®Tc(OH©¹)Θ§‘ρc(Na+)®T2c(SO32©¹)+c(HSO3©¹)Θ§c(SO32©¹)ΓΌc(H2SO3)Θ§Ι B¥μΈσΘΜ
CΘ°pH=7 ±Θ§c(H+)=c(OH©¹)Θ§Ι C¥μΈσΘΜ
DΘ°”…ΆΦΩ…÷ΣpH=7 ±Θ§c(SO32©¹)=c(HSO3©¹)Θ§Ι D¥μΈσΘΜ
Ι ¥πΑΗΈΣAΘΜ
ΔΎ―«ΝρΥαΒΡΒΎ“Μ≤ΫΒγάκΖΫ≥Χ ΫΈΣΘΚH2SO3![]() H++HSO3©¹Θ§ΗυΨίΆΦœσΩ…÷ΣΘ§pH=1.8 ±Θ§c(H2SO3 )=c(HSO3- )Θ§”…Ka=
H++HSO3©¹Θ§ΗυΨίΆΦœσΩ…÷ΣΘ§pH=1.8 ±Θ§c(H2SO3 )=c(HSO3- )Θ§”…Ka=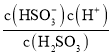 Ω…÷ΣΘ§H2SO3ΒΡΒΎ“ΜΦΕΒγάκΤΫΚβ≥Θ ΐKa1Γ÷c(H+)=10-1.8ΓΘ
Ω…÷ΣΘ§H2SO3ΒΡΒΎ“ΜΦΕΒγάκΤΫΚβ≥Θ ΐKa1Γ÷c(H+)=10-1.8ΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σœ¬Ν–Ζ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΘΚ
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)ΓςH1
2 H2(g)+ O2(g)= 2H2O(g)ΓςH2
C(s)+ O2(g)=CO2(g)ΓςH3
‘ρΖ¥”Π4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)ΒΡΓςHΈΣ
A. 12ΓςH3+5ΓςH2-2ΓςH1 B. 2ΓςH1-5ΓςH2-12ΓςH3
C. 12ΓςH3-5ΓςH2-2ΓςH1 D. ΓςH1-5ΓςH2-12ΓςH3
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γœ¬ΆΦΥυ ΨΘ§![]() Θ§
Θ§![]() Θ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
Θ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
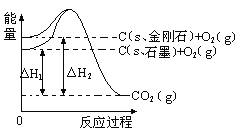
A. ·ΡΪΚΆΫπΗ’ ·ΒΡΉΣΜ· «Έοάμ±δΜ·
B.ΫπΗ’ ·ΒΡΈ»Ε®–‘«Ω”Ύ ·ΡΪ
C. ·ΡΪΒΡΦϋΡή±»ΫπΗ’ ·ΒΡΦϋΡή¥σ1.9kJ/mol
D. C(sΘ§ ·ΡΪ)=C(sΘ§ΫπΗ’ ·)Θ§ΗΟΖ¥”ΠΒΡHΘΦ0
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΔώ.(1)Ά§Έ¬Ά§―Ιœ¬Θ§H2Θ®gΘ©ΘΪCl2Θ®gΘ©=2HClΘ®gΘ©Θ§‘ΎΙβ’’ΚΆΒψ»ΦΧθΦΰœ¬ΒΡΠΛHΘ®Μ·―ßΦΤΝΩ ΐœύΆ§Θ©Ζ÷±πΈΣΠΛH1ΓΔΠΛH2Θ§‘ρΠΛH1________ΠΛH2ΓΘ
Δρ.κ¬(N2H4)Ω…ΉςΈΣΜπΦΐΖΔΕ·ΜζΒΡ»ΦΝœΓΘ
(2)κ¬(N2H4)”κ―θΜ·ΦΝN2O4(l)Ζ¥”Π…ζ≥…N2ΚΆΥ°’τΤχΓΘ“―÷ΣΘΚ
ΔΌN2(g)ΘΪ2O2(g)=N2O4(l)ΓΓΠΛH1ΘΫΘ≠195 kJΓΛmolΘ≠1
ΔΎN2H4(l)ΘΪO2(g)=N2(g)ΘΪ2H2O(g)ΓΓΠΛH2ΘΫΘ≠534 kJΓΛmolΘ≠1
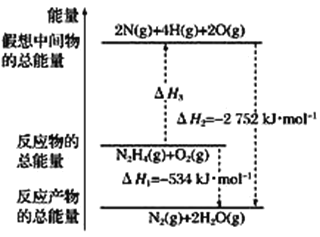
‘ΦΤΥψ1 molκ¬(l)”κN2O4(l)Άξ»ΪΖ¥”Π…ζ≥…N2ΚΆΥ°’τΤχ ±Ζ≈≥ωΒΡ»»ΝΩΈΣ________Θ§–¥≥ωκ¬(l)ΚΆN2O4(l)Ζ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΘΚ___________________________________________________ΓΘ
Θ®3Θ©”–ΙΊκ¬Μ·―ßΖ¥”ΠΒΡΡήΝΩ±δΜ·»γΆΦΥυ ΨΘ§“―÷ΣΕœΝ―1 molΜ·―ßΦϋΥυ–ηΒΡΡήΝΩ(kJ)ΘΚ
NΓ‘NΈΣ942ΓΔO=OΈΣ500ΓΔNΓΣNΈΣ154Θ§‘ρΕœΝ―1 mol NΓΣHΦϋΥυ–ηΒΡΡήΝΩ «________ kJΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·―ß–ΓΉι”Ο»γœ¬ΖΫΖ®≤βΕ®Ψ≠¥ΠάμΚσΒΡΖœΥ°÷–±ΫΖ”ΒΡΚ§ΝΩΘ®ΖœΥ°÷–≤ΜΚ§Η…»≈≤βΕ®ΒΡΈο÷ Θ©ΓΘ
ΔώΘ°”Ο“―ΉΦ»Ζ≥ΤΝΩΒΡKBrO3ΙΧΧε≈δ÷Τ“ΜΕ®ΧεΜΐΒΡa molΓΛL1 KBrO3±ξΉΦ»ή“ΚΘΜ
ΔρΘ°»Γv1 mL…œ ω»ή“ΚΘ§Φ”»κΙΐΝΩKBrΘ§Φ”HSO4ΥαΜ·Θ§»ή“Κ―’…Ϊ≥ ΉΊΜΤ…ΪΘΜ
ΔσΘ°œρΔρΥυΒΟ»ή“Κ÷–Φ”»κv2 mLΖœΥ°ΘΜ
ΔτΘ°œρΔσ÷–Φ”»κΙΐΝΩKIΘΜ
ΔθΘ°”Οb molΓΛL1 Na2S2O3±ξΉΦ»ή“ΚΒΈΕ®Δτ÷–»ή“Κ÷Ν«≥ΜΤ…Ϊ ±Θ§ΒΈΦ”2ΒΈΒμΖέ»ή“ΚΘ§ΦΧ–χΒΈΕ®÷Ν÷’ΒψΘ§Ι≤œϊΚΡNa2S2O3»ή“Κv2 mLΓΘ
“―÷ΣΘΚI2+2Na2S2O3=2NaI+ Na2S4O6
Na2S2O3ΚΆNa2S4O6»ή“Κ―’…ΪΨυΈΣΈό…Ϊ
Θ®1Θ©Δώ÷–≈δ÷Τ»ή“Κ”ΟΒΫΒΡ≤ΘΝß“«Τς”–…’±≠ΓΔ≤ΘΝßΑτΓΔΫΚΆΖΒΈΙήΚΆ____________ΓΘ
Θ®2Θ©Δώ÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «_______________________________ΓΘ
Θ®3Θ©Δσ÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ «_________________________________ΓΘ
Θ®4Θ©Δτ÷–Φ”KI«ΑΘ§»ή“Κ―’…Ϊ–κΈΣΜΤ…ΪΘ§‘≠“ρ «______________________________ΓΘ
Θ®5Θ©KI”κKBrO3Έο÷ ΒΡΝΩΙΊœΒΈΣnΘ®KIΘ©Γί6nΘ®KBrO3Θ© ±Θ§KI“ΜΕ®ΙΐΝΩΘ§άμ”… «________ΓΘ
Θ®6Θ©Δθ÷–ΒΈΕ®÷Ν÷’ΒψΒΡœ÷œσ «_____________________________ΓΘ
Θ®7Θ©ΖœΥ°÷–±ΫΖ”ΒΡΚ§ΝΩΈΣ___________gΓΛL1Θ®±ΫΖ”ΡΠΕϊ÷ ΝΩΘΚ94 gΓΛmol 1Θ©ΓΘ
Θ®8Θ©”…”ΎBr2ΨΏ”–____________–‘÷ Θ§Δρ~Δτ÷–Ζ¥”Π–κ‘ΎΟή±’»ίΤς÷–Ϋχ––Θ§Ζώ‘ρΜα‘λ≥…≤βΕ®ΫαΙϊΤΪΗΏΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦΥυ Ψ «≤ΩΖ÷ΕΧ÷ήΤΎ‘ΣΥΊ‘≠Ή”ΑκΨΕ”κ‘≠Ή”–ρ ΐΒΡΙΊœΒΘ§‘ρœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©

A.M‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷ΟΈΣΘΚΒΎ»ΐ÷ήΤΎΘ§IVΉε
B.YΓΔZΓΔMΓΔNΥΡ÷÷‘ΣΥΊ–Έ≥…ΒΡ‘≠Ή”ΑκΨΕΉν¥σΒΡ «Y
C.XΓΔNΝΫ÷÷‘ΣΥΊΒΡΤχΧ§«βΜ·ΈοΒΡΖ–Βψœύ±»Θ§«Α’ΏΫœΒΆ
D.Y‘ΣΥΊΚΆX‘ΣΥΊΩ…“‘–Έ≥…Y2X2–ΆΜ·ΚœΈοΘ§“θΓΔ―τάκΉ”Έο÷ ΒΡΝΩ÷°±»ΈΣ1ΘΚ1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒγΫβNa2CO3»ή“ΚΩ…÷Τ»ΓNaHCO3»ή“ΚΚΆNaOH»ή“ΚΘ§‘≠άμ»γœ¬ΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «

A.bΦΪΈΣ“θΦΪΘ§≤ζ…ζΒΡΤχΧεAΈΣH2
B.»ή“Κ÷–ΒΡNa+Ά®ΙΐΫΜΜΜΡΛ”…bΦΪ “ΒΫaΦΪ “
C.BΩ…“‘ Ι”ΟœΓNaOH»ή“ΚΘ§Τδ–ßΙϊ”≈”Ύ¥ΩΥ°
D.aΦΪΒγΦΪΖ¥”ΠΈΣ4CO32Θ≠ΘΪ2H2OΘ≠4eΘ≠=4HCO3Θ≠ΘΪO2Γϋ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦ «ΙΛ“ΒΒγΫβ±ΞΚΆ ≥―ΈΥ°ΒΡΉΑ÷Ο Ψ“βΆΦΘ§œ¬Ν–”–ΙΊΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «(ΓΓΓΓ)

A.ΉΑ÷Ο÷–≥ωΩΎΔΌ¥ΠΒΡΈο÷ «¬»ΤχΘ§≥ωΩΎΔΎ¥ΠΒΡΈο÷ ««βΤχ
B.ΗΟάκΉ”ΫΜΜΜΡΛ÷ΜΡή»Ο―τάκΉ”Ά®ΙΐΘ§≤ΜΡή»Ο“θάκΉ”Ά®Ιΐ
C.ΉΑ÷Ο÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣClΘ≠ΘΪ2HΘΪ![]() Cl2ΓϋΘΪH2Γϋ
Cl2ΓϋΘΪH2Γϋ
D.ΗΟΉΑ÷Ο «ΫΪΒγΡήΉΣΜ·ΈΣΜ·―ßΡή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩPCl3ΚΆPCl5ΕΦ «÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΓΘΫΪPCl3(g)ΚΆCl2(g)≥δ»κ2LΒΡΚψ»ίΟή±’»ίΤς÷–Θ§‘Ύ“ΜΕ®ΧθΦΰœ¬ΖΔ…ζΖ¥”ΠPCl3(g)+Cl2(g)![]() PCl5(g)Θ§ΓςH<0≤Δ”Ύ10min ±¥οΒΫΤΫΚβΓΘ”–ΙΊ ΐΨί»γœ¬ΘΚœ¬Ν–≈–Εœ’ΐ»ΖΒΡ «
PCl5(g)Θ§ΓςH<0≤Δ”Ύ10min ±¥οΒΫΤΫΚβΓΘ”–ΙΊ ΐΨί»γœ¬ΘΚœ¬Ν–≈–Εœ’ΐ»ΖΒΡ «
PCl3(g) | Cl2(g) | PCl5(g) | |
≥θ Φ≈®Ε»/(molL-1) | 2.0 | 1.0 | 0 |
ΤΫΚβ≈®Ε»/(molL-1) | c1 | c2 | 0.4 |
A.10minΡΎΘ§v(Cl2)=0.02mol/(Lmin)
B.…ΐΗΏΈ¬Ε»Θ§Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐ‘ω¥σ
C.Ζ¥”Π¥οΒΫΤΫΚβ ±»ίΤςΡΎΒΡ―Ι«Ω”κ≥θ Φ ±»ίΤςΒΡ―Ι«Ω÷°±»ΈΣ1:2
D.ΤΫΚβΚσ“ΤΉΏ2.0molPCl3ΚΆ1.0molCl2Θ§œύΆ§ΧθΦΰœ¬‘Ό¥οΤΫΚβ ±Θ§c(PCl5)<0.2molL-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com