
【题目】如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是( )

A.M在周期表中的位置为:第三周期,IV族
B.Y、Z、M、N四种元素形成的原子半径最大的是Y
C.X、N两种元素的气态氢化物的沸点相比,前者较低
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1:1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.已知冰的熔化热为![]()
![]() ,冰中氢键键能为20
,冰中氢键键能为20![]() ,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中
,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中![]() 的氢键
的氢键
B.已知:![]() 石墨
石墨![]() ,
,![]()
![]() .
.![]() ,
,![]()
![]() .
.![]() 石墨
石墨![]() ,
,![]()
![]() .则
.则![]() ,
,![]()
![]()
C.实验测得环己烷![]() 、环己烯
、环己烯![]() 和苯
和苯![]() 的标准燃烧热分别为
的标准燃烧热分别为![]()
![]() 、
、![]()
![]() 和
和![]()
![]() ,可以证明在苯分子中不存在独立的碳碳双键
,可以证明在苯分子中不存在独立的碳碳双键
D.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为![]() ,
,![]() 若加入少量醋酸钠固体,则
若加入少量醋酸钠固体,则![]() 向左移动,
向左移动,![]() 减小,Ka变小
减小,Ka变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:________________________。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式为__________________。
④当看到装置C中导管液面上升时应进行的操作是______________________。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______________________作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2S2O32- = 2I- +S4O62-),当看到____________________________现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______。
(2)已知:
甲醇脱水反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应:2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应:CH3CH2OH(g)=CH3OCH3(g) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应 C2H4 (g)+H2O(g)C2H5OH(g)的△H=_______kJ·mol-1。与间接水合法相比,气相直接水合法的优点是______
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系:(其中nH2O:nC2H4=1:1)
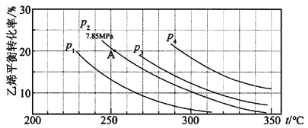
①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强 P1、P2、P3、P4 的大小顺序为_______,理由是_______。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290 ℃,压强 6.9MPa, n H2 O ︰ nC2 H4 =0.6︰1。乙烯的转化率为 5℅,若要进一步提高乙烯的转化率, 除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式_________.已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH=_____.
②泡沫灭火器中通常装有NaHCO3 溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为___________(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是_____.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:
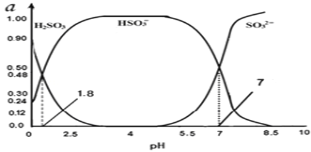
①图中pH=7时,溶液中离子浓度关系正确的是___。
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3![]() H++ HSO3﹣的平衡常数的数值____.
H++ HSO3﹣的平衡常数的数值____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25 ℃水的电离常数是1.0×10-12
B.中性溶液的c(H+)=![]()
C.纯水在100 ℃时,c(H+)>10-7 mol·L-1,所以此时纯水中c(H+)>c(OH-)
D.pH<7的溶液一定是酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
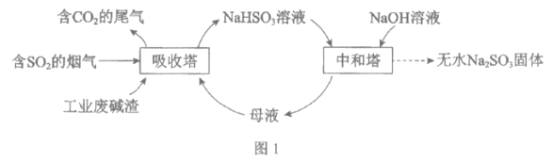
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
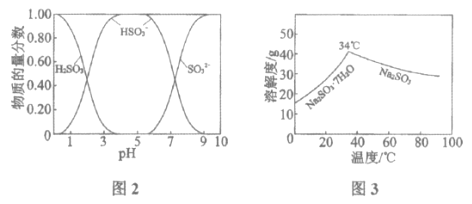
已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:______________。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为______________。
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:____________。
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ![]()
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) ![]()
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l) ![]()
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是______________。
④吸收塔中的温度不宣过高,可能的原因是______________(写出1种即可)。
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液______________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.醋酸与CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.向NaClO溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O
C.Cu与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.向银氨溶液中加入CH3CHO溶液并水浴加热:CH3CHO+2Ag(NH3)2OH→CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com