
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
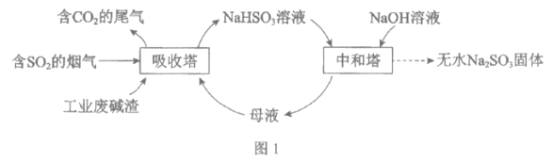
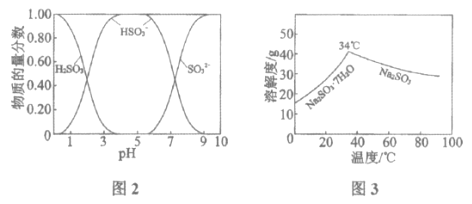
已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:______________。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为______________。
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:____________。
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ![]()
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) ![]()
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l) ![]()
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是______________。
④吸收塔中的温度不宣过高,可能的原因是______________(写出1种即可)。
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液______________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
【答案】CO32-+H2O![]() OH-+HCO3- 4~5 溶液中,HSO3-存在:HSO3-
OH-+HCO3- 4~5 溶液中,HSO3-存在:HSO3-![]() H++SO32-和HSO3-+H2C
H++SO32-和HSO3-+H2C![]() H2SO3+OH-,HSO3-的电离程度强于水解程度 2SO2(g)+CO32-(aq)+H2O(1)=2HSO3-(aq)+CO2(g)
H2SO3+OH-,HSO3-的电离程度强于水解程度 2SO2(g)+CO32-(aq)+H2O(1)=2HSO3-(aq)+CO2(g) ![]() 防止SO2的溶解度下降;防止HSO3-受热分解;防止HSO3-的氧化速率加快等 隔绝空气,加热浓缩至有大量固体析出,高于34℃过滤
防止SO2的溶解度下降;防止HSO3-受热分解;防止HSO3-的氧化速率加快等 隔绝空气,加热浓缩至有大量固体析出,高于34℃过滤
【解析】
(1)Na2CO3为强碱弱酸盐,水解呈碱性;
(2)①由图象可知pH在4~5时NaHSO3的物质的量分数最高;
②NaHSO3溶液中c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
③已知:①SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1=-164.3kJmol-1,②CO2(g)+2OH- (aq)═CO32- (aq)+H2O(l)△H2=-109.4kJmol-1,③2HSO3- (aq)═SO32- (aq)+SO2(g)+H2O(l)△H3=+34.0kJmol-1,利用盖斯定律将①-②-③可得Na2CO3溶液吸收SO2生成HSO3-的热化学方程式;
④HSO3-不稳定,易分解,如温度过高,可导致气体的溶解度下降,且HSO3-易被氧化;
(3)得无水Na2SO3固体,温度应高于34℃,且防止被氧化。
(1)Na2CO3为强碱弱酸盐,水解呈碱性,离子方程式为CO32-+H2O![]() OH-+HCO3-;
OH-+HCO3-;
(2)①由图象可知pH在4~5时NaHSO3的物质的量分数最高;
②NaHSO3溶液中存在HSO3-![]() H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O![]() H2SO3+OH-,c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
H2SO3+OH-,c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
③已知:①SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1=-164.3kJmol-1,②CO2(g)+2OH- (aq)═CO32- (aq)+H2O(l)△H2=-109.4kJmol-1,③2HSO3- (aq)═SO32- (aq)+SO2(g)+H2O(l)△H3=+34.0kJmol-1,利用盖斯定律将①-②-③可得Na2CO3溶液吸收SO2生成HSO3-的热化学方程式为2SO2(g)+CO32-(aq)+H2O(l)═2HSO3-(aq)+CO2 (g)△H=-88.9 kJmol-1;
④HSO3-不稳定,易分解,如温度过高,可导致气体的溶解度下降,且HSO3-易被氧化,则吸收塔的温度不易过高;
(3)得无水Na2SO3固体,温度应高于34℃,且防止被氧化,可隔绝空气,加热浓缩至有大量固体析出。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述不正确的是( )
化学方程式 | 平衡常数K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |
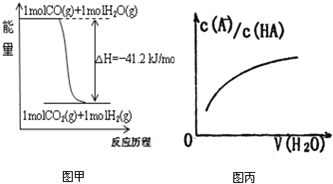
A.已知CO的燃烧热283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.某温度下,pH =11的NH3H2O和pH =1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为0.05molL-1
C.在常温下,X2(g) 和 H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,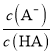 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是( )

A.M在周期表中的位置为:第三周期,IV族
B.Y、Z、M、N四种元素形成的原子半径最大的是Y
C.X、N两种元素的气态氢化物的沸点相比,前者较低
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将绿矾(FeSO47H2O)隔绝空气条件下加强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
(实验一)为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
猜想 | 实验操作 | 预期现象 |
猜想一:铁元素只显_______价 | ① 取溶液样品,滴入KSCN溶液;②取溶液样品,滴入稀酸性KMnO4溶液 | 加入KSCN溶液无明显现象稀酸性KMnO4溶液颜色______ |
猜想二:铁元素只显_______价 | 加入KSCN溶液呈______色;稀酸性KMnO4溶液颜色无变化 | |
猜想三:铁元素显+2,+3价 | 加入KSCN溶液呈血红色;稀酸性KMnO4溶液颜色褪色 |
(实验二)为进一步探究该反应的产物,进行了如下图所示的实验:
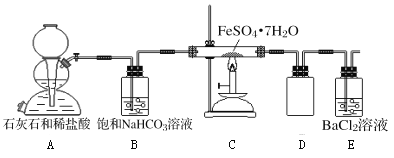
(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是_________。
(2)饱和NaHCO3的作用是______,其水溶液呈碱性的原因(用离子方程式解释)____________。
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为____________________________。
(4)该组同学设计的装置存在着一个明显的缺陷是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )

A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如图:
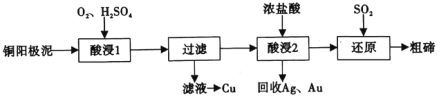
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为___。
(2)“酸浸1”过程中,为加快浸出速率,可采取的方法有___(填1种)。“酸浸2”时温度过高会使Te的浸出率降低,原因是___。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为___;“还原”过程中,发生反应的离子方程式为___。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为___。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是___。
(5)常温下,向lmol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=___。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)![]() cZ(g) ΔH的影响,以A和B的物质的量之比为m∶n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) ΔH的影响,以A和B的物质的量之比为m∶n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )

A.ΔH>0
B.m+n<c
C.升高温度,υ正、υ逆都增大,平衡常数减小
D.恒温恒压时,向已达平衡的体系中加入少量Z(g),再次达到平衡后Z的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是一种二元弱酸,对于0.1mol·L1的过氧化氢溶液,下列叙述不正确的是()
A.H2O2的电离方程式可写作H2O2![]() H++HO2-,HO2-
H++HO2-,HO2-![]() H++O22-
H++O22-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以AgZSM为催化剂,在容积为1 L的容器中,相同时间下测得0.1 mol NO转化为N2的转化率随温度变化如图所示[无CO时反应为2NO(g)![]() N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g)
N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)]。下列说法正确的是 ( )
2CO2(g)+N2(g)]。下列说法正确的是 ( )

A.反应2NO![]() N2+O2的ΔH>0
N2+O2的ΔH>0
B.达平衡后,其他条件不变,使n(CO)/n(NO)>1,CO转化率下降
C.X点可以通过更换高效催化剂提高NO转化率
D.Y点再通入CO、N2各0.01 mol,此时v(CO,正)<v(CO,逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com