
【题目】H2O2是一种二元弱酸,对于0.1mol·L1的过氧化氢溶液,下列叙述不正确的是()
A.H2O2的电离方程式可写作H2O2![]() H++HO2-,HO2-
H++HO2-,HO2-![]() H++O22-
H++O22-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______。
(2)已知:
甲醇脱水反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应:2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应:CH3CH2OH(g)=CH3OCH3(g) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应 C2H4 (g)+H2O(g)C2H5OH(g)的△H=_______kJ·mol-1。与间接水合法相比,气相直接水合法的优点是______
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系:(其中nH2O:nC2H4=1:1)
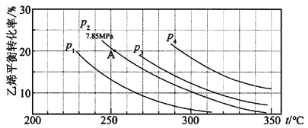
①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强 P1、P2、P3、P4 的大小顺序为_______,理由是_______。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290 ℃,压强 6.9MPa, n H2 O ︰ nC2 H4 =0.6︰1。乙烯的转化率为 5℅,若要进一步提高乙烯的转化率, 除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
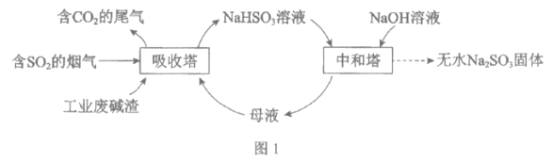
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
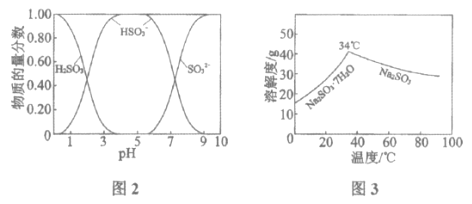
已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:______________。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为______________。
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:____________。
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ![]()
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) ![]()
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l) ![]()
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是______________。
④吸收塔中的温度不宣过高,可能的原因是______________(写出1种即可)。
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液______________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是( )

A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阳极区,在氢化酶作用下发生反应H2+2MV2+=2H++2MV+
C.正极区,在固氮酶催化作用下发生反应N2+6MV++6H2O=2NH3+6MV2++6OH-
D.电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组利用如图装置来制备无水AlCl3或NaH(已知:AlCl3、NaH遇水都能迅速发生反应)。下列说法错误的是
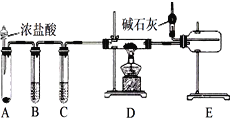
A. 制备无水AlCl3:装置A中的试剂可能是高锰酸钾
B. 点燃D处酒精灯之前需排尽装置中的空气
C. 装置C中的试剂为浓硫酸
D. 制备无水AlCl3和NaH时球形干燥管中碱石灰的作用完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠![]() 是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出![]() ,
,![]() 有类似
有类似![]() 的性质。某兴趣小组探究亚氯酸钠的制备与性质。
的性质。某兴趣小组探究亚氯酸钠的制备与性质。
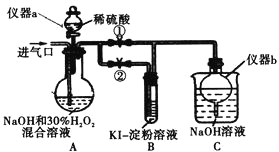
(I)制备亚氯酸钠
关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,从进气口通入足量
,从进气口通入足量![]() ,充分反应。
,充分反应。
(1)仪器a的名称为_________,仪器b的作用是_________。
(2)装置A中生成![]() 的化学方程式为_________。
的化学方程式为_________。
(3)若从装置A反应后的溶液中获得![]() 晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
(II)探究亚氯酸钠的性质
停止通![]() 气体,再通入空气一段时间后,关闭止水夹
气体,再通入空气一段时间后,关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,向A中滴入稀硫酸。
,向A中滴入稀硫酸。
(4)请写出这时A中发生反应的离子方程式_________。
(5)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(6)B中现象为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.醋酸与CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.向NaClO溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O
C.Cu与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.向银氨溶液中加入CH3CHO溶液并水浴加热:CH3CHO+2Ag(NH3)2OH→CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
A. 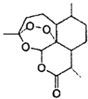 青蒿素的分子式是
青蒿素的分子式是![]()
B. 青蒿素所有碳原子均在同一平面上
C. 青蒿素在碱性条件下不能稳定存在
D. 青蒿素可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z位于不同短周期,原子序数依次增大。X、Z同主族,二者的原子序数之和是Y原子序数的两倍,主族元素W的原子最外层电子数比电子层数多4。下列说法不正确的是( )
A.简单离子半径:W>Z>X
B.X、Y、Z都能与W组成离子化合物
C.X、Y组成的化合物可与W单质反应
D.Q是Z、W组成的化合物,1 molQ中约含有6.02×1023个阴离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com