
【题目】某化学学习小组利用如图装置来制备无水AlCl3或NaH(已知:AlCl3、NaH遇水都能迅速发生反应)。下列说法错误的是
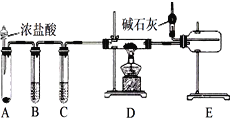
A. 制备无水AlCl3:装置A中的试剂可能是高锰酸钾
B. 点燃D处酒精灯之前需排尽装置中的空气
C. 装置C中的试剂为浓硫酸
D. 制备无水AlCl3和NaH时球形干燥管中碱石灰的作用完全相同
【答案】D
【解析】
由图可知,装置A为氯气或氢气的制备装置,装置B的目的是除去氯气或氢气中的氯化氢,装置C的目的是干燥氯气或氢气,装置E收集反应生成的氯化铝或氢化钠,碱石灰的作用是防止空气中水蒸气进入E中,或吸收过量的氯气防止污染环境。
A项、浓盐酸可与高锰酸钾常温下发生氧化还原反应制备氯气,故A正确;
B项、因为金属铝或金属钠均能与氧气反应,所以点燃D处酒精灯之前需排尽装置中的空气,故B正确;
C项、装置C中的试剂为浓硫酸,目的是干燥氯气或氢气,故C正确;
D项、制备无水AlCl3时,碱石灰的作用是防止空气中水蒸气进入E中,吸收过量的氯气防止污染环境,制备无水NaH时,碱石灰的作用是防止空气中水蒸气进入E中,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
Ⅱ.肼(N2H4)可作为火箭发动机的燃料。
(2)肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
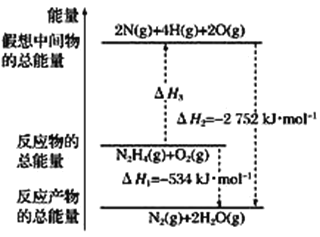
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为________,写出肼(l)和N2O4(l)反应的热化学方程式:___________________________________________________。
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是________ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )

A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)![]() cZ(g) ΔH的影响,以A和B的物质的量之比为m∶n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) ΔH的影响,以A和B的物质的量之比为m∶n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )

A.ΔH>0
B.m+n<c
C.升高温度,υ正、υ逆都增大,平衡常数减小
D.恒温恒压时,向已达平衡的体系中加入少量Z(g),再次达到平衡后Z的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10–9;Ksp(BaSO4)=1.1×10–10。下列推断正确的是( )
A.可以用0.36 mol·L–1的Na2SO4溶液给钡离子中毒患者洗胃
B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C.若误饮c(Ba2+)=1.0×10–5 mol·L–1的溶液时,会引起钡离子中毒
D.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是一种二元弱酸,对于0.1mol·L1的过氧化氢溶液,下列叙述不正确的是()
A.H2O2的电离方程式可写作H2O2![]() H++HO2-,HO2-
H++HO2-,HO2-![]() H++O22-
H++O22-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),△H<0并于10min时达到平衡。有关数据如下:下列判断正确的是
PCl5(g),△H<0并于10min时达到平衡。有关数据如下:下列判断正确的是
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(molL-1) | 2.0 | 1.0 | 0 |
平衡浓度/(molL-1) | c1 | c2 | 0.4 |
A.10min内,v(Cl2)=0.02mol/(Lmin)
B.升高温度,反应的平衡常数增大
C.反应达到平衡时容器内的压强与初始时容器的压强之比为1:2
D.平衡后移走2.0molPCl3和1.0molCl2,相同条件下再达平衡时,c(PCl5)<0.2molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连
B.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
C.常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D.保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:

(1)打开K2,闭合K1,若所盛溶液为CuSO4溶液:则A为________极,B极的电极反应式为__________。
(2)打开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是__________,总反应化学方程式是_________。
(3)如要用电解方法精炼粗铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是______,反应一段时间后电解质溶液中Cu2+浓度_____(填“增大”、“减小”、“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com