
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),△H<0并于10min时达到平衡。有关数据如下:下列判断正确的是
PCl5(g),△H<0并于10min时达到平衡。有关数据如下:下列判断正确的是
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(molL-1) | 2.0 | 1.0 | 0 |
平衡浓度/(molL-1) | c1 | c2 | 0.4 |
A.10min内,v(Cl2)=0.02mol/(Lmin)
B.升高温度,反应的平衡常数增大
C.反应达到平衡时容器内的压强与初始时容器的压强之比为1:2
D.平衡后移走2.0molPCl3和1.0molCl2,相同条件下再达平衡时,c(PCl5)<0.2molL-1
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式_________.已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH=_____.
②泡沫灭火器中通常装有NaHCO3 溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为___________(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是_____.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:
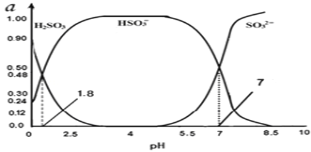
①图中pH=7时,溶液中离子浓度关系正确的是___。
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3![]() H++ HSO3﹣的平衡常数的数值____.
H++ HSO3﹣的平衡常数的数值____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿石是制取硫酸的主要原料,主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化)。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
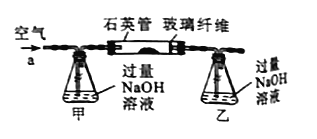
(1)鼓人空气的作用是___________,锥形瓶乙中NaOH溶液的作用是___________。
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
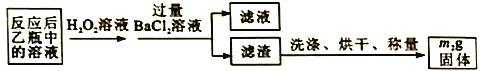
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。
(3)洗涤滤渣的方法是______________________。
(4)该黄铁矿石中硫元素的质量分数为___________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣;②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤;③将滤液稀释至250mL;④取25.00mL稀释液,用0.1000mol·L-1的酸性KMnO4溶液滴定,三次滴定实验,平均消耗酸性KMnO4溶液25.00mL。
(5)操作②中用铁粉作还原剂,测定铁的含量___________(填“偏高”或“偏低”或“不变”),操作④中滴定时酸性KMnO4溶液盛装在___________填“酸式滴定管”或“碱式滴定管”),③中稀释液中Fe2+的物质的量浓度c(Fe2+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组利用如图装置来制备无水AlCl3或NaH(已知:AlCl3、NaH遇水都能迅速发生反应)。下列说法错误的是
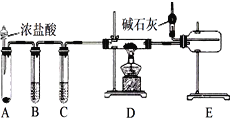
A. 制备无水AlCl3:装置A中的试剂可能是高锰酸钾
B. 点燃D处酒精灯之前需排尽装置中的空气
C. 装置C中的试剂为浓硫酸
D. 制备无水AlCl3和NaH时球形干燥管中碱石灰的作用完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.醋酸与CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.向NaClO溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O
C.Cu与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.向银氨溶液中加入CH3CHO溶液并水浴加热:CH3CHO+2Ag(NH3)2OH→CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属接触时,接触部位会发生“电偶腐蚀”。金属铁和铜在自来水和海水中,相同时间发生的腐蚀情况如图。下列有关说法正确的是( )
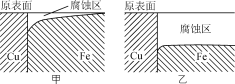
A.甲图中的介质为海水
B.腐蚀过程中电能转化为化学能
C.铁电极反应式为Fe-3e-=Fe3+
D.若在金属表面涂油漆,可以减弱铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。下列说法中,不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. 浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).写出CH3CH=CHCH3这种烯烃的顺、反异构体的结构简式:_________、___________。
(2).某芳香烃的分子式为C8H10,它可能有的同分异构体共 _____种,其中__________(结构简式)在苯环上的一溴代物只有两种
(3).写出乙醇在浓硫酸的作用下,加热到170℃时发生的反应方程
式 ________________________________________________________________ 。
(4).化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为_______________。
(5).某有机物由C、H、O三种元素组成,它的红外吸收光谱表明有羟基和烃基上的C—H键的红外吸收峰,且烃基与羟基上的氢原子个数之比为2:1,升温使其汽化,测其密度是相同条件下H2的31倍。该有机物的结构简式为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com