
ЁОЬтФПЁПХ№ЫсЃЈH3BO3ЃЉЪЧвЛжжживЊЕФЛЏЙЄдСЯЃЌЙуЗКгІгУгкВЃСЇЁЂвНвЉЁЂЗЪСЯЕШЙЄвеЁЃвЛжжвдХ№УОПѓЃЈКЌMg2B2O5ЁЄH2OЁЂSiO2МАЩйСПFe2O3ЁЂAl2O3ЃЉЮЊдСЯЩњВњХ№ЫсМАЧсжЪбѕЛЏУОЕФЙЄвеСїГЬШчЯТЃК

ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉдк95 ЁцЁАШмЧжЁБХ№УОПѓЗлЃЌВњЩњЕФЦјЬхдкЁАЮќЪеЁБжаЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________ЁЃ
ЃЈ2ЃЉЁАТЫдќ1ЁБЕФжївЊГЩЗжга_________ЁЃЮЊМьбщЁАЙ§ТЫ1ЁБКѓЕФТЫвКжаЪЧЗёКЌгаFe3+РызгЃЌПЩбЁгУЕФЛЏбЇЪдМСЪЧ_________ЁЃ
ЃЈ3ЃЉИљОнH3BO3ЕФНтРыЗДгІЃКH3BO3+H2O![]() H++B(OH)4ЃЌKa=5.81ЁС1010ЃЌПЩХаЖЯH3BO3ЪЧ_______ЫсЃЛдкЁАЙ§ТЫ2ЁБЧАЃЌНЋШмвКpHЕїНкжС3.5ЃЌФПЕФЪЧ_______________ЁЃ
H++B(OH)4ЃЌKa=5.81ЁС1010ЃЌПЩХаЖЯH3BO3ЪЧ_______ЫсЃЛдкЁАЙ§ТЫ2ЁБЧАЃЌНЋШмвКpHЕїНкжС3.5ЃЌФПЕФЪЧ_______________ЁЃ
ЃЈ4ЃЉдкЁАГСУОЁБжаЩњГЩMg(OH)2ЁЄMgCO3ГСЕэЕФРызгЗНГЬЪНЮЊ__________ЃЌФИвКОМгШШКѓПЩЗЕЛи___________ЙЄађбЛЗЪЙгУЁЃгЩМюЪНЬМЫсУОжЦБИЧсжЪбѕЛЏУОЕФЗНЗЈЪЧ_________ЁЃ
ЁОД№АИЁПNH3+NH4HCO3ЃН(NH4)2CO3 Fe2O3ЁЂAl2O3ЁЂSiO2 KSCN вЛдЊШѕ зЊЛЏЮЊH3BO3ЃЌДйНјЮіГі 2Mg2++2H2O+3CO32ЃЃНMg(OH)2MgCO3Ё§+2HCO3ЃЃЈЛђ2Mg2++H2O+2CO32ЃЃНMg(OH)2MgCO3Ё§+CO2ЁќЃЉ ШмНў ИпЮТБКЩе
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнСїГЬЭМжЊХ№УОПѓЗлжаМгШыСђЫсяЇШмвКВњЩњЕФЦјЬхЮЊАБЦјЃЌгУЬМЫсЧтяЇШмвКЮќЪеЃЌЗДгІЗНГЬЪНЮЊЃКNH3+NH4HCO3=(NH4)2CO3;
ЃЈ2ЃЉТЫдќIЮЊВЛгыСђЫсяЇШмвКЗДгІЕФFe2O3ЁЂAl2O3ЁЂSiO2;МьбщFe3+,ПЩбЁгУЕФЛЏбЇЪдМСЮЊKSCNЃЛ
ЃЈ3ЃЉгЩХ№ЫсЕФРыНтЗНГЬЪНжЊЃЌХ№ЫсдкЫЎШмвКжаЪЧЭЈЙ§гыЫЎЗжзгЕФХфЮЛзїгУВњЩњЧтРызгЃЌЖјШ§МлХ№дзгзюЖржЛФмдйаЮГЩвЛИіХфЮЛМќЃЌЧвХ№ЫсВЛФмЭъШЋНтРыЃЌЫљвдХ№ЫсЮЊвЛдЊШѕЫсЃЛдкЁАЙ§ТЫ2ЁБЧАЃЌНЋШмвКpHЕїНкжС3.5ЃЌФПЕФЪЧНЋB(OH)4зЊЛЏЮЊH3BO3ЃЌВЂДйНјH3BO3ЮіГіЃЛ
ЃЈ4ЃЉГСУОЙ§ГЬжагУЬМЫсяЇШмвКгыMg2+ЗДгІЩњГЩMg(OH)2MgCO3ЃЌГСУОЙ§ГЬЕФРызгЗДгІЮЊЃК2Mg2++2H2O+3CO32-=Mg(OH)2MgCO3Ё§+2HCO3-ЃЛФИвКМгШШЗжНтКѓЩњГЩСђЫсяЇШмвКЃЌПЩвдЗЕЛиЁАШмНўЁБЙЄађбЛЗЪЙгУЃЛМюЪНЬМЫсУОВЛЮШЖЈЃЌИпЮТЯТПЩвдЗжНтЃЌЙЪгЩМюЪНЬМЫсУОжЦБИЧсжЪбѕЛЏУОЕФЗНЗЈЪЧИпЮТБКЩеЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌгУ0.1000 mol/L NaOHШмвКЗжБ№ЕЮЖЈ20. 00 mL 0.1000 mol/L бЮЫсКЭ20. 00 mL 0.1000 mol/L ДзЫсШмвКЃЌЕУЕН2ЬѕЕЮЖЈЧњЯпЃЌШчЯТЭМЫљЪОЁЃ
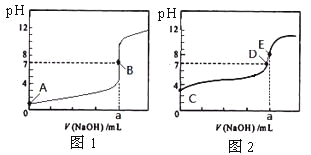
ШєвдHAБэЪОЫсЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЕЮЖЈбЮЫсЕФЧњЯпЪЧЭМ2
B. ДяЕНBЁЂDзДЬЌЪБЃЌСНШмвКжаРызгХЈЖШОљЮЊc(Na+)=C(A-)
C. ДяЕНBЁЂEзДЬЌЪБЃЌЗДгІЯћКФЕФn(CH3COOH)>n(HCl)
D. ЕБ0 mL<V(NaOH) <20. 00 mLЪБЃЌЖдгІЛьКЯШмвКжаИїРызгХЈЖШгЩДѓЕНаЁЕФЫГађОљЮЊc(AЁЊ) >c(Na+)>c(H+) >c(OHЁЊ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNAДњБэАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
A.БъзМзДПіЯТЃЌ11.2 L Cl2ШмгкЫЎЃЌШмвКжаClЃЃЌClOЃКЭHClOЕФЮЂСЃЪ§жЎКЭЮЊNA
B.32.5 g FeCl3ЫЎНтаЮГЩЕФFe(OH)3НКЬхСЃзгЪ§ЮЊ0.2NA
C.1 mol PC13гы1 mol 36C12ЗДгІДяЕНЦНКтЪБЃЌВњЮяжаКЌPЁЊ36C1МќЪ§ФПЮЊ2NA
D.ЗДгІ![]() +
+ ![]() Ёњ
Ёњ ![]() +
+ ![]() жаЃЌУПЩњГЩ294g
жаЃЌУПЩњГЩ294g ![]() ЪЭЗХЕФжазгЪ§ЮЊ3NA
ЪЭЗХЕФжазгЪ§ЮЊ3NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЬЬхНчУцЩЯЧПЫсЕФЮќИНКЭРыНтЪЧЖрЯрЛЏбЇдкЛЗОГЁЂДпЛЏЁЂВФСЯПЦбЇЕШСьгђбаОПЕФживЊПЮЬтЁЃЯТЭМЮЊЩйСПHClЦјЬхЗжзгдк253 KБљБэУцЮќИНКЭШмНтЙ§ГЬЕФЪОвтЭМЃЌЯТСаа№ЪіДэЮѓЕФЪЧ

A.БљБэУцЕквЛВужаЃЌHClвдЗжзгаЮЪНДцдк
B.БљБэУцЕкШ§ВужаЃЌБљЕФЧтМќЭјИёНсЙЙБЃГжВЛБф
C.БљБэУцИїВужЎМфЃЌОљДцдкПЩФцЗДгІHCl![]() H++Cl
H++Cl
D.БљБэУцЕкЖўВужаЃЌH+ХЈЖШЮЊ5ЁС103 molЁЄL1ЃЈЩшБљЕФУмЖШЮЊ0.9 gЁЄcm3ЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЙигкЯТСаШмвКЕФЫЕЗЈДэЮѓЕФЪЧ
A.ФГЮяжЪЕФШмвКжагЩЫЎЕчРыГіЕФc(H+)=1ЁС10-10mol/L,дђИУШмвКЕФpHПЩФмЮЊ4Лђ10
B.вбжЊ0.1 mol/L NaClOШмвКЕФpHЮЊ9.7ЃЌ0.1 mol/LNaFШмвКЕФpHЮЊ7.5ЃЌдђЕШЬхЛ§СНШмвКжаРызгзмЪ§ДѓаЁЙиЯЕЮЊЃКN(NaClO)>N(NaF)
C.НЋ0.2 mol/LЕФФГвЛдЊЫсHAШмвККЭ0.1 mol/LNaOHШмвКЕШЬхЛ§ЛьКЯКѓШмвКpHДѓгк7ЃЌдђЫљЕУШмвКжаЃК2c(OH-)=2c(H+)+c(HA)-c(A-)
D.ЯђБЅКЭТШЫЎжаМгШыNaOHШмвКжСPH=7ЃЌдђЫљЕУШмвКжаЃКc(Na+) >c(Cl-) >c(ClO-) >c(OH-)= c(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкЯТСаЪЕбщзАжУЛђВйзїЕФЫЕЗЈжаЃЌе§ШЗЕФЪЧ(ЁЁЁЁ)



A.ЂйПЩгУгкЪЕбщЪвгУMnO2ЙЬЬхгыХЈбЮЫсЙВШШЃЌжЦШЁВЂЪеМЏИЩдяЁЂДПОЛЕФCl2
B.ЂкЪЕбщжаШєзѓБпУоЛЈБфГШЩЋЃЌгвБпУоЛЈБфРЖЩЋЃЌдђФмжЄУїбѕЛЏадЃКCl2ЃОBr2ЃОI2
C.ЂлЪЕбщЪдЙмжаЛсЩњГЩКьЩЋГСЕэ
D.гУЭМЂмВйзїПЩЬсШЁЕтЫЎжаЕФЕт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЁЂBЁЂCЁЂDЮЊдзгађЪ§вРДЮдіДѓЕФЖЬжмЦкжїзхдЊЫиЃЌaЁЂdЗжБ№ЪЧAЁЂDдЊЫиЖдгІЕФЕЅжЪЃЌmЁЂnЁЂpЁЂqЪЧгЩетаЉдЊЫижаЕФВПЗждЊЫизщГЩЕФЛЏКЯЮяЃЌЦјЬхpГЃзїЙћЪЕДпЪьМСЃЌmЁЂnЮЊСНжжГЃМћЕФвКЬхЁЃЩЯЪіЮяжЪЗЂЩњЕФзЊЛЏЙиЯЕШчЯТЭМЫљЪО(ЗДгІЬѕМўвбТдШЅ)ЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
![]()
A.дзгАыОЖгЩДѓЕНаЁЕФЫГађЮЊЃКD>B>C>A
B.МђЕЅЧтЛЏЮяЕФЗаЕуЃКB<C
C.dгыmЗДгІЕФЯжЯѓЮЊИЁдквКУцЩЯЫФДІгЮЖЏ
D.CгыDаЮГЩЕФЛЏКЯЮяжавЛЖЈКЌгаРызгМќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЛњЮяжаКЌгаЩйСПдгжЪ![]() РЈКХжаЪЧдгжЪ
РЈКХжаЪЧдгжЪ![]() ЃЌГ§дгЗНЗЈе§ШЗЕФЪЧ
ЃЌГ§дгЗНЗЈе§ШЗЕФЪЧ
A.ввДМ![]() ввЫс
ввЫс![]() ЃКМгШыЬМЫсФЦШмвКЃЌеёЕДЃЌОВжУЃЌЗжвК
ЃКМгШыЬМЫсФЦШмвКЃЌеёЕДЃЌОВжУЃЌЗжвК
B.ЯѕЛљБН![]() СђЫс
СђЫс![]() ЃКНЋЦфМгШыNaOHШмвКжаЃЌеёЕДЃЌОВжУЃЌЗжвК
ЃКНЋЦфМгШыNaOHШмвКжаЃЌеёЕДЃЌОВжУЃЌЗжвК
C.ввШЉ![]() ввЫсввѕЅ
ввЫсввѕЅ![]() ЃКМгШыЧтбѕЛЏФЦШмвКЃЌеёЕДЃЌОВжУЃЌЗжвК
ЃКМгШыЧтбѕЛЏФЦШмвКЃЌеёЕДЃЌОВжУЃЌЗжвК
D.фхввЭщ![]() фх
фх![]() ЃКМгШыЫФТШЛЏЬМЃЌеёЕДЃЌОВжУЃЌЗжвК
ЃКМгШыЫФТШЛЏЬМЃЌеёЕДЃЌОВжУЃЌЗжвК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНсКЯЯТБэЛиД№ЯТСаЮЪЬтЃЈОљЮЊГЃЮТЯТЕФЪ§ОнЃЉЃК
Ыс | ЕчРыГЃЪ§(Ka) | Ыс | ЕчРыГЃЪ§(Ka) | Ыс | ЕчРыГЃЪ§(Ka) | Ыс | ЕчРыГЃЪ§(Ka) |
CH3COOH | 1.8ЁС10-5 | H2CO3 | K1=4.4ЁС10-7 K2=4.7ЁС10-11 | H2C2O 4 | K1=5.4ЁС10-2 K2=5.4ЁС10-5 | H2S | K1=1.3ЁС10-7 K2=7.1ЁС10-15 |
HClO | 3ЁС10-8 |
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЭЌХЈЖШЕФCH3COO-ЁЂHCO3-ЁЂCO32-ЁЂHC2O4-ЁЂClO-ЁЂS2-жаНсКЯH+ЕФФмСІзюШѕЕФЪЧ__________ЁЃ
ЃЈ2ЃЉГЃЮТЯТ0.1 molL-1ЕФCH3COOHШмвКдкМгЫЎЯЁЪЭЙ§ГЬжаЃЌЯТСаБэДяЪНЕФЪ§ОнвЛЖЈБфаЁЕФЪЧ_______ЃЈЬюађКХЃЉЁЃ
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
ЃЈ3ЃЉ0.1 molL-1ЕФH2C2O4ШмвКгы0.1 molL-1ЕФKOHЕФШмвКЕШЬхЛ§ЛьКЯКѓЫљЕУШмвКГЪЫсадЃЌИУШмвКжаИїРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ______________ЁЃ
ЃЈ4ЃЉpHЯрЭЌЕФNaClOКЭCH3COOKШмвКЃЌЦфШмвКЕФЮяжЪЕФзюХЈЖШЕФДѓаЁЙиЯЕЪЧЃКCH3COONa______NaClOЃЌСНШмвКжаЃК[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)]ЃЈЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБЃЉЁЃ
ЃЈ5ЃЉЯђ0.1 molL-1CH3COOH ШмвКжаЕЮМг NaOH ШмвКжС c(CH3COOH): c(CH3COO-)=5 : 9ЃЌДЫЪБШмвКpH=_______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com