
(12分)在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)△H<0,反应中NH3的浓度变化如下图:
2NH3(g)△H<0,反应中NH3的浓度变化如下图:

(1)根据上图,4min~5min之间,反应处于_________状态;(填“平衡”或“非平衡”)。
计算0~4min内,平均反应速率υ(NH3)= 。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,反应达到新平衡后,则NH3的物质的量浓度不可能为 。
A.0.2mol·L-1 B.0.12mol·L-1 C.0.10mol·L-1 D.0.08mol·L-1
(3)反应达到平衡后,第5分钟末,保持其它条件不变,把容器的体积缩小为原来的一半,则平衡________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”)。
(4)在第5分钟末,将容器体积缩小为原来的一半后,若在第8分钟末达到新的平衡时(此时NH3的浓度约为0.25mol·L-1)。请在上图中画出第5分钟末到平衡时NH3浓度的变化曲线。
(1)平衡(2分)0.025mol·L-1·min-1(2分)(2)A、C(2分)(3)向正反应方向(2分)不变(2分)(4)如图(2分)
【解析】
试题分析:(1)4-5分钟时氨气的浓度不变,说明反应到达平衡。 氨气的反应速率=01/4=0.025mol·L-1·min-1(2)若氮气和氢气完全反应生成氨气的浓度为0.2mol/L,但由于是可逆反应,物质不可能完全转化,所以氨气的浓度不可能为0.2mol/L,原平衡时氨气的浓度为0.1mol/L,改变温度,平衡肯定移动,所以氨气的浓度不可能是0.1mol/L。所以选A、C。(3)其它条件不变,容器的体积缩小,是加压,平衡向正反应方向移动,由于温度不变,所以平衡常数不变。
(4)将容器的体积缩小到一半,则浓度都变成原来的2倍,平衡正向移动,氮气和氢气的浓度逐渐减小,氨气的浓度逐渐增大,所以得到图像
考点:化学平衡常数的应用,化学平衡移动。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:填空题
(A)【化学—物质结构与性质】(13分)
物质中铁含量的测定方法是多种多样的。
I.土壤中铁含量的测定是先将Fe3+还原为Fe2+,然后使Fe3+与邻啡罗啉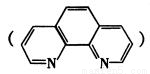 结合显橙红色,再用比色法测定。其中涉及以下反应:4FeCl3 + 2NH2OH·HCl=4FeCl2 + N2O↑+ 6HCI + H2O。
结合显橙红色,再用比色法测定。其中涉及以下反应:4FeCl3 + 2NH2OH·HCl=4FeCl2 + N2O↑+ 6HCI + H2O。
(1)基态Fe2+的核外电子排布式为 。
(2)羟胺(NH2OH)中采用sp3杂化的原子是 ;羟胺极易溶于水,主要原因是 。
(3)羟胺的组成各元素中,元素的第一电离能(I1)由大到小的顺序为 (用元素符号表示)。
(4)吡啶 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有σ键的物质的量为 mol。
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有σ键的物质的量为 mol。
Ⅱ.奶粉中铁含量的测定是在酸性介质中使Fe3+与K4Fe(CN)6生成普鲁士蓝(Ⅱ)(化学式为Fe4[Fe(CN)6]3),再用光度法测定铁的含量。反应原理如下:
3K4Fe(CN)6+4FeCl3=Fe4[Fe(CN)6]3↓+12KCl
(5)Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有_______;
a.共价键
b.氢键
c.配位键
d.金属键
e.离子键
(6)若K4 Fe(CN)6和FeCl3的物质的量按某种比例发生反应,可生成普鲁士蓝(I),其晶胞结构如下图所示:据此判断普鲁士蓝(I)中n(K+):n(Fe3+):n (Fe2+):n (CN—)= 。

查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邢台市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知反应X + Y = M + N为吸热反应,对这个反应的下列说法中正确的是
A.X和Y的总能量一定低于M和N的总能量
B.因为该反应是吸热反应,故一定要加热反应才能进行
C.X的能量一定低于M的能量,Y的能量一定低于N的能量
D.破坏反应物中的化学键所吸收的能量小于形成生成物化学键所放出的能量
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省静宁县高一上学期期末考试化学试卷(解析版) 题型:选择题
氧化还原反应的实质是
A.化合价的升降 B.分子中各原子重新组合
C.电子的得失或偏移 D.氧原子的得失
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省静宁县高一上学期期末考试化学试卷(解析版) 题型:选择题
下列溶液中与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
A.150 mL 1 mol·L-1 的NaCl B.75 mL 2 mol·L-1 的NH4Cl
C.150 mL 3 mol·L-1 的KCl D.75 mL 2 mol·L-1 的CaCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高三上学期期末考化学试卷(解析版) 题型:选择题
在同体积0.1 mol·L-1的H2SO4、HCl、CH3COOH溶液中,加入足量的Zn,下列说法中错误的是
A.硫酸中放出氢气量最多 B.反应速率H2SO4>HCl> CH3COOH
C.放出氢气量:HCl> CH3COOH D.放出氢气量: HCl= CH3COOH
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高三上学期期末考化学试卷(解析版) 题型:选择题
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,

下列表述中正确的是
A.反应的化学方程式为.2 M N
N
B.t2时,正逆反应速率相等达到平衡状态
C.t1时,N的浓度是M浓度的2倍
D.t3时,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省滁州市六校上高一联考化学试卷(解析版) 题型:填空题
(4分)对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 ___________
(2)除去食盐溶液中的水 ___________
(3)淡化海水
(4)KCl中含有KClO3
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省东莞市高一上学期期末化学A试卷(解析版) 题型:选择题
化学与社会、生产、生活紧切相关。下列说法正确的是
A.高纯度的硅单质用于制作光导纤维
B.从海水中提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com