
(A)【化学—物质结构与性质】(13分)
物质中铁含量的测定方法是多种多样的。
I.土壤中铁含量的测定是先将Fe3+还原为Fe2+,然后使Fe3+与邻啡罗啉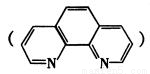 结合显橙红色,再用比色法测定。其中涉及以下反应:4FeCl3 + 2NH2OH·HCl=4FeCl2 + N2O↑+ 6HCI + H2O。
结合显橙红色,再用比色法测定。其中涉及以下反应:4FeCl3 + 2NH2OH·HCl=4FeCl2 + N2O↑+ 6HCI + H2O。
(1)基态Fe2+的核外电子排布式为 。
(2)羟胺(NH2OH)中采用sp3杂化的原子是 ;羟胺极易溶于水,主要原因是 。
(3)羟胺的组成各元素中,元素的第一电离能(I1)由大到小的顺序为 (用元素符号表示)。
(4)吡啶 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有σ键的物质的量为 mol。
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有σ键的物质的量为 mol。
Ⅱ.奶粉中铁含量的测定是在酸性介质中使Fe3+与K4Fe(CN)6生成普鲁士蓝(Ⅱ)(化学式为Fe4[Fe(CN)6]3),再用光度法测定铁的含量。反应原理如下:
3K4Fe(CN)6+4FeCl3=Fe4[Fe(CN)6]3↓+12KCl
(5)Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有_______;
a.共价键
b.氢键
c.配位键
d.金属键
e.离子键
(6)若K4 Fe(CN)6和FeCl3的物质的量按某种比例发生反应,可生成普鲁士蓝(I),其晶胞结构如下图所示:据此判断普鲁士蓝(I)中n(K+):n(Fe3+):n (Fe2+):n (CN—)= 。

(1)1s22s22p63s23p63d6或[Ar]3d6
(2)N、O;羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水(3)N>O>H
(4)11 (5)a、c、e (6)1:1:1:6
【解析】
试题分析:I.(1)铁的原子序数是26,则根据核外电子排布规律可知基态Fe2+的核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6。
(2)羟胺(NH2OH)氮元素还有1对孤对电子,氧元素含有2对孤对电子,其价层电子对数均是4,所以采用sp3杂化的原子是N和O;由于羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水。
(3)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以羟胺的组成各元素中,元素的第一电离能(I1)由大到小的顺序为N>O>H。
(4)单键都是σ键,双键是由1个σ键和1个π组成的,则由吡啶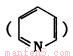 的结构式可知l mol吡啶中含有σ键的物质的量为11 mol。
的结构式可知l mol吡啶中含有σ键的物质的量为11 mol。
Ⅱ.奶粉中铁含量的测定是在酸性介质中使Fe3+与K4Fe(CN)6生成普鲁士蓝(Ⅱ)(化学式为Fe4[Fe(CN)6]3),再用光度法测定铁的含量。反应原理如下:
3K4Fe(CN)6+4FeCl3=Fe4[Fe(CN)6]3↓+12KCl
(5)Fe4[Fe(CN)6]3是一种配合物,则越大含有配位健。阴阳离子之间存在离子键。C于N之间存在共价键,答案选ace。
(6)根据搅拌结构可知搅拌含有CN—的个数是12×1/4=3,亚铁离子和铁离子的个数均是4×1/8=0.5。根据电中性可知晶胞中钾离子个数是3—0.5×2—0.5×3=0.5,所以断普鲁士蓝(I)中n(K+):n(Fe3+):n (Fe2+):n (CN—)=1:1:1:6。
考点:考查核外电子排布、化学键、第一电离能以及晶胞计算


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高二上学期期末化学试卷(解析版) 题型:填空题
(12分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:
c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中c(H+) c(OH-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:

①绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为 。
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省濉溪县高二上学期期末考试化学试卷(解析版) 题型:填空题
(8分)已知-NH2连在苯环上显碱性,-CONH2连在苯环上显中性。现有分子式为C7H7O2N的有机物,分子结构中有一个苯环和互为对位的两个侧链,试写出该分子式对应的符合下列条件的四种同分异构体的结构简式:
甲:既有酸性,又有碱性________________________________;
乙:只有酸性________________________________;
丙:既无酸性,又无碱性________________________________;
丁:只有碱性________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期一模考试化学试卷(解析版) 题型:填空题
(化学——有机化学基础)(共15分)
(1)今有如下图所示的三种有机物:

①写出丙中含氧官能团的名称 ;
②这三种物质中,互为同分异构体的是 ;
③写出乙和过量NaOH溶液共热时反应的化学方程 。
(2)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。

①A的同分异构体还有 种;
②聚合物F的结构简式是 ;
③B转化为C的化学方程式是 ;
写出与E具有相同官能团的一种同分异构体的结构简式 ;
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期一模考试化学试卷(解析版) 题型:选择题
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是

A.图中共有两条曲线X和Y,其中曲线y表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和c
C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
D.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
常温下,电解质溶液的性质与变化是多样的,下列说法正确的是
A.pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B.往稀氨水中加水, 的值变小
的值变小
C.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+) = c(OH—)+2c(S2—)
D.Ca(ClO) 2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:
2KClO3+H2C2O4+H2SO4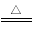 2ClO2↑+K2SO4+2CO2↑+2H2O,据此,下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,据此,下列说法不正确的是
A.KClO3发生还原反应
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.每1 mol ClO2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邢台市高二上学期期末考试化学试卷(解析版) 题型:选择题
某原电池的总反应为:Cu + 2Fe3+ = Cu2+ + 2Fe2+
A | B | C | D | |
电极材料 | Cu、Zn | Cu、Ag | Fe、Zn | Cu、C |
插入溶液 | FeCl3 | Fe(NO3) 2 | CuSO4 | Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高三上学期期末考化学试卷(解析版) 题型:填空题
(12分)在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)△H<0,反应中NH3的浓度变化如下图:
2NH3(g)△H<0,反应中NH3的浓度变化如下图:

(1)根据上图,4min~5min之间,反应处于_________状态;(填“平衡”或“非平衡”)。
计算0~4min内,平均反应速率υ(NH3)= 。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,反应达到新平衡后,则NH3的物质的量浓度不可能为 。
A.0.2mol·L-1 B.0.12mol·L-1 C.0.10mol·L-1 D.0.08mol·L-1
(3)反应达到平衡后,第5分钟末,保持其它条件不变,把容器的体积缩小为原来的一半,则平衡________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”)。
(4)在第5分钟末,将容器体积缩小为原来的一半后,若在第8分钟末达到新的平衡时(此时NH3的浓度约为0.25mol·L-1)。请在上图中画出第5分钟末到平衡时NH3浓度的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com