
��12�֣�������ʵĵ���ƽ�⡢�����ˮ��ƽ�����������ܽ�ƽ������ڻ�ѧƽ�⡣����Ҫ��ش�����
��1������������������ˮ�����侻ˮ��ԭ���� �������ӷ���ʽ��ʾ����
��2�������£�ȡ0.2 mol��L��1 HCl��Һ��0.2 mol��L��1 MOH��Һ�������ϣ���û����Һ���pH��5��д��MOH�ĵ��뷽��ʽ�� ��
��3��0.1mol/L��NaHA��Һ�У���֪�й�����Ũ���ɴ�С��˳��Ϊ��
c��Na+��>c��HA����>c��H2A��>c��A2����
�ٸ���Һ��c��H���� c��OH�������>������<����=������
�����������жϵ������� �������ֽ��ͣ���
��4����Cr2O �ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10��3 mol��L��1��Cr2O
�ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10��3 mol��L��1��Cr2O ��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����
��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����

���̷���ѧʽΪFeSO4��7H2O����Ӧ��I�������ӷ���ʽΪ ��
����������ķ�ˮ��c(Cr3��)=3.0��10��6 mol��L��1�����ˮ��c(Fe3��)= _________ mol��L��1����Ksp[Fe(OH)3]��4.0��10��38��Ksp[Cr(OH) 3]��6.0��10��31��
��1��Al3+ + 3H2O  Al(OH)3 + 3H+��2�֣�д�������͡��������÷֣� ��2��MOH
Al(OH)3 + 3H+��2�֣�д�������͡��������÷֣� ��2��MOH M+ + OH����2�֣�д���������÷֣� ��3����< ��2�֣�д��С�ڡ������֣� ��NaHA��Һ�Լ��ԣ�˵��HA��ˮ��̶ȴ��ڵ���̶ȣ�2�֣���4����Cr2O72�� + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O��2�֣� ��2��10��13��2�֣�
M+ + OH����2�֣�д���������÷֣� ��3����< ��2�֣�д��С�ڡ������֣� ��NaHA��Һ�Լ��ԣ�˵��HA��ˮ��̶ȴ��ڵ���̶ȣ�2�֣���4����Cr2O72�� + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O��2�֣� ��2��10��13��2�֣�
��������
�����������1������������������ˮ��������Ϊ��������ˮ���ɵ� Al3+ ����ˮ�����ɿ�Al(OH)3����������ˮ�е����ʣ����ӷ���ʽΪ��Al3+ + 3H2O  Al(OH)3 + 3H+ ����2��0.2 mol��L��1 HCl��Һ��0.2 mol��L��1 MOH��Һ�������ϣ���û����Һ���pH��5��˵��MOH��������뷽��ʽΪ��MOH
Al(OH)3 + 3H+ ����2��0.2 mol��L��1 HCl��Һ��0.2 mol��L��1 MOH��Һ�������ϣ���û����Һ���pH��5��˵��MOH��������뷽��ʽΪ��MOH M+ + OH������3��c��H2A��>c��A2����˵��HA����ˮ��̶ȴ��ڵ���̶ȣ�HA��ˮ����Һ�Լ��ԣ���c��H����<c��OH��������4����Cr2O72����ǿ�����ԣ�Fe2+�л�ԭ�ԣ�����������ԭ��Ӧ�����ӷ���ʽΪ��Cr2O72�� + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O����Ksp[Cr(OH) 3]��c(Cr3��)��c3��OH����=3.0��10��6��c3��OH����=6.0��10��31����c3��OH����=2.0��10��25��Ksp[Fe(OH)3]= c(Fe3��) ��c3��OH����=4.0��10��38��
M+ + OH������3��c��H2A��>c��A2����˵��HA����ˮ��̶ȴ��ڵ���̶ȣ�HA��ˮ����Һ�Լ��ԣ���c��H����<c��OH��������4����Cr2O72����ǿ�����ԣ�Fe2+�л�ԭ�ԣ�����������ԭ��Ӧ�����ӷ���ʽΪ��Cr2O72�� + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O����Ksp[Cr(OH) 3]��c(Cr3��)��c3��OH����=3.0��10��6��c3��OH����=6.0��10��31����c3��OH����=2.0��10��25��Ksp[Fe(OH)3]= c(Fe3��) ��c3��OH����=4.0��10��38��
c(Fe3��) ��2.0��10��25=4.0��10��38��c(Fe3��)= 2��10��13 mol��L��1
���㣺�����ˮ�⼰��Ӧ�á��ܶȻ��ļ��㡢���ӷ���ʽ����д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�һ��ѧ�����п��Ի�ѧ���������棩 ���ͣ�ѡ����
���й��ڽ����˵������ȷ����
A��������۲����� B��������ͨ����Ĥ
C�������ܲ��������ЧӦ D�����岻�ȶ������ú����ײ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����л�������ķ�����ȷ����
A | B | C | D |
|
|
| CH3OCH3 |
����ͬϵ�� | ���ĺ��������� | ֬���� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ������һ�����У��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ����
A��Cu��FeCl3��Һ��Ӧ��Cu+ Fe3+= Cu2++ Fe2+
B��̼�������ϡ���CO32- + 2H+ = H2O + CO2��
C��FeSO4��Һ��NaOH��Һ��Ӧ�� Fe2+ + 2OH- = Fe(OH)2��
D����������ˮ��Cl2 + H2O = 2H+ + ClO- + Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ������һ�����У��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��ʵ�������������ɫϸ��ƿ�е��Լ���
A���ⵥ�� B��Ũ���� C��Ũ���� D��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ������һ�����У�߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
ͨ��NO�������ɼ��NO�ĺ������乤��ԭ����ͼ��ʾ������˵���������

A����װ��ʵ�ֻ�ѧ������ܵ�ת��
B���õ�ص��ܷ�ӦΪ2NO + O2 = 2NO2
C��NiO�缫�ĵ缫��Ӧʽ: NO + O2- - 2e�� �� NO2
D������2.24L��O2���뷴Ӧʱ��ת����0.4mole��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ������һ�����У�߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���������
A����ѧ��Ӧ��Ȼ���������ı仯
B�����ȷ�Ӧ��һ�����Է�����
C����ѧ��Ӧһ���л�ѧ���Ķ������γ�
D����Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�Ϫ�ظ�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������������Һ���ܴ����������
A��Na+��CO32����SO42����H+
B��K+��[Al(OH)4]����H+��Cl��
C��Fe2+��K+��H+��NO3��
D��Al3+��H+��NO3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ�����и���3��������黯ѧ�Ծ��������棩 ���ͣ������
(A)����ѧ�����ʽṹ�����ʡ���13�֣�
�������������IJⶨ�����Ƕ��ֶ����ġ�
I���������������IJⶨ���Ƚ�Fe3+��ԭΪFe2+��Ȼ��ʹFe3+���ڷ�����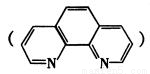 ����ԳȺ�ɫ�����ñ�ɫ���ⶨ�������漰���·�Ӧ��4FeCl3 + 2NH2OH��HCl��4FeCl2 + N2O��+ 6HCI + H2O��
����ԳȺ�ɫ�����ñ�ɫ���ⶨ�������漰���·�Ӧ��4FeCl3 + 2NH2OH��HCl��4FeCl2 + N2O��+ 6HCI + H2O��
��1����̬Fe2+�ĺ�������Ų�ʽΪ ��
��2���ǰ�(NH2OH)�в���sp3�ӻ���ԭ���� ���ǰ���������ˮ����Ҫԭ���� ��
��3���ǰ�����ɸ�Ԫ���У�Ԫ�صĵ�һ������(I1)�ɴ�С��˳��Ϊ ����Ԫ�ط��ű�ʾ����
��4����� ���ڷ��������Ǻ������л��l mol����к��ЦҼ������ʵ���Ϊ mol��
���ڷ��������Ǻ������л��l mol����к��ЦҼ������ʵ���Ϊ mol��
���̷����������IJⶨ�������Խ�����ʹFe3+��K4Fe(CN)6������³ʿ��������ѧʽΪFe4[Fe(CN)6]3�������ù�ȷ��ⶨ���ĺ�������Ӧԭ�����£�
3K4Fe(CN)6+4FeCl3��Fe4[Fe(CN)6]3��+12KCl
��5��Fe4[Fe(CN)6]3��һ���������к��еĻ�ѧ����_______��
a�����ۼ�
b�����
c�����
d��������
e�����Ӽ�
��6����K4 Fe(CN)6��FeCl3�����ʵ�����ij�ֱ���������Ӧ����������³ʿ����I�����侧���ṹ����ͼ��ʾ���ݴ��ж���³ʿ����I����n(K+)��n(Fe3+)��n (Fe2+)��n (CN��)= ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com