
【题目】某同学在实验室研究Na2CO3和NaHCO3的性质及相互转化.
(1)分别向浓度均为0.1mol/LNa2CO3及NaHCO3溶液中滴加几滴酚酞试剂:
①Na2CO3溶液由无色变为红色,其原因是 .
②NaHCO3溶液也由无色变为红色,其原因是 .
③比较两份溶液的颜色,红色较浅的是(填化学式).
(2)研究NaHCO3与CaCl2的反应.
实验序号 | 实验操作 | 实验现象 |
实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
①实验1中没有出现白色浑浊的原因是 .
②实验2中形成的分散系属于 .
③用离子方程式表示实验2中发生的反应 .
(3)在不引入其他杂质的前提下,实现Na2CO3与NaHCO3之间的转化,请在图中标出所用的试剂、用量或物质的浓度(反应前后溶液体积的变化可忽略). 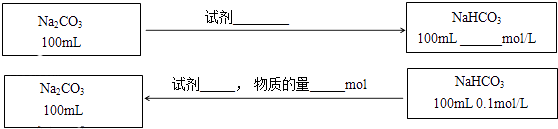
【答案】
(1)CO32﹣+H2O?HCO3﹣+OH﹣;HCO3﹣+H2O?H2CO3+OH﹣ , HCO3﹣?H++CO32﹣ , 水解程度大于电离程度;NaHCO3
(2)HCO3﹣浓度低,电离出的CO32﹣浓度更低,导致c(Ca2+)?c(CO32﹣)<Ksp(CaCO3);胶体;Ca2++2HCO3﹣=CaCO3↓+CO2+H2O
(3)CO2|0.2|NaOH|0.01
【解析】解:(1.)浓度均为0.1mol/LNa2CO3及NaHCO3溶液中碳酸根离子水解溶液呈碱性,碳酸氢根离子水解程度大于电离程度,所以溶液也呈碱性,相等浓度时,Na2CO3水解产生的氢氧根溶液大于NaHCO3水解产生的氢氧根,所以Na2CO3溶液的碱性强于NaHCO3的溶液,所以有①Na2CO3溶液由无色变为红色,其原因是 CO32﹣+H2OHCO3﹣+OH﹣;②NaHCO3溶液也由无色变为红色,其原因是 HCO3﹣+H2OH2CO3+OH﹣ , HCO3﹣H++CO32﹣ , 水解程度大于电离程度;③比较两份溶液的颜色,红色较浅的是NaHCO3 ,
所以答案是:①CO32﹣+H2OHCO3﹣+OH﹣;②HCO3﹣+H2OH2CO3+OH﹣ , HCO3﹣H++CO32﹣ , 水解程度大于电离程度;③NaHCO3;
(2.)根据题中的实验现象可知,0.001mol/L NaHCO3溶液中电离出的CO32﹣浓度更低,导致c(Ca2+)c(CO32﹣)<Ksp(CaCO3)因而溶液中不出现沉淀,0.1mol/L NaHCO3溶液中电离出的碳酸根离子浓度高一些,与钙离子形成了碳酸钙沉淀及胶体,所以有①实验1中没有出现白色浑浊的原因是 HCO3﹣浓度低,电离出的CO32﹣浓度更低,导致(Ca2+)c(CO32﹣)<Ksp(CaCO3),所以答案是:HCO3﹣浓度低,电离出的CO32﹣浓度更低,导致c(Ca2+)c(CO32﹣)<Ksp(CaCO3);②用激光笔照射,出现光亮的通路为胶体的性质,所以实验2中形成的分散系属于胶体,所以答案是:胶体;③实验2中发生的反应的离子方程式为Ca2++2HCO3﹣=CaCO3↓+CO2+H2O,所以答案是:Ca2++2HCO3﹣=CaCO3↓+CO2+H2O;
(3.)100mL0.1mol/LNa2CO3及中通入CO2生成碳酸氢钠,根据钠元素守恒可知,得到的碳酸氢钠溶液的浓度为0.2mol/L,将100mL0.1mol/LNaHCO3溶液转化为碳酸钠溶液,则加入0.01mol的氢氧化钠固体即可,所以答案是:CO2;0.2;NaOH;0.01.


科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的化学方程式为( )
A.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) Δ H=-11.46 kJ/mol
B.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-11.46 kJ/mol
C.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
D.KOH(aq)+![]() H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关纳米炭粉的说法中不正确的是
A. 纳米炭粉与普通木炭的化学性质完全不同
B. 相同条件下,纳米炭粉的吸附能力比木炭强
C. 纳米炭粉与水形成的分散系较稳定
D. 纳米炭粉与水形成的分散系能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
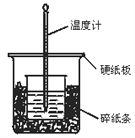
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)烧杯间填满碎纸条的作用是________________________;
(3)大烧杯上如不盖硬纸板,求得的中和热数值_____(填“偏大”“偏小”“无影响”);
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),简述理由______________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生。据此可推断丙物质是( )
A. Al2(SO4)3 B. FeSO4
C. NaOH D. BaCl2
【答案】B
【解析】若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,应为NaOH和Al2(SO4)3的反应,反应的方程式有:Al2(SO4)3+6NaOH═2Al(OH)3↓+3Na2SO4、Al(OH)3+NaOH═NaAlO2+2H2O,现象为先生成白色沉淀,后沉淀溶解,则丁为NaOH,乙为Al2(SO4)3,丁溶液滴入甲溶液中,无明显现象发生,只有BaCl2与NaOH不反应,则甲为BaCl2,因此,丙为FeSO4。故选B。
【题型】单选题
【结束】
14
【题目】右图表示在某溶液中滴加Ba(OH)2 溶液时,沉淀的物质的量随Ba(OH)2 的物质的量的变化关系。该溶液的成分可能是

A. MgSO4 B. Al2 (SO4 )3 C. Fe2 (SO4 )3 D. NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知物质的量浓度的酸测定未知物质的量浓度的碱时,会导致待测碱液的物质的量浓度偏低的操作是( )
①酸式滴定管在滴定前未将液面调至“0”刻度,而调在“2.40”
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③滴定前酸式滴定管尖嘴部分未充满溶液,滴定后充满溶液
④滴定中不慎将锥形瓶内液体摇出瓶外
⑤滴定达终点时,视线高于滴定管内液面凹面的最低点.
A.①②④
B.②③④
C.②③⑤
D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3性质的说法正确的是( )
A. 在水中的溶解性:NaHCO3>Na2CO3 B. 热稳定性:NaHCO3<Na2CO3
C. 与酸反应的速率:NaHCO3<Na2CO3 D. 只可能让NaHCO3转化成Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是
A. 乙醇不能发生取代反应
B. C4H10有三种同分异构体
C. 氨基酸、淀粉均属于高分子化合物
D. 乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com