
����Ŀ��50 mL 0.50 mol/L������50 mL 0.55 mol/L NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
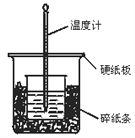
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��________��
��2���ձ���������ֽ����������________________________��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ_____������ƫ������ƫС������Ӱ��������
��4��ʵ���и���60 mL 0.50 mol/L�����50 mL 0.55 mol/L NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������________�����������������������������к���________��������������������������������______________________________________��
���𰸡� ���β�������� ����ʵ������е�������ʧ ƫС ����� ��� �������������������Լ�������Ķ����йأ�������![]() ��Һ��
��Һ��![]() ��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����
��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����![]() ˮʱ�ų����ȣ��к������
ˮʱ�ų����ȣ��к������
����������1�����к��Ȳⶨ�м������ȼƹ����֪����ȱ�ٻ��β����������
��2����ֽ���������Ǽ���ʵ�������������ʧ��ʹʵ��ⶨ���к�������С��
��3�����ձ�����Ӳֽ�壬��ʵ������оͻ���������ʧ���Ӷ�ʹ�¶ȼƲ�õ��¶�ƫ�ͣ�ʹ�к�����ֵƫС��
��4���к�����ָ�������кͷ�Ӧ����1 mol H2O���ų��������������������ء�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ��ˮ������Ե��ǣ� ��
A.AlCl3
B.Na2CO3
C.NaCl
D.K2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. 1 mol CO2 ������Ϊ44g/mol
B. CO2��Ħ������Ϊ44g
C. NA��CO2��������CO2����Է�����������ֵ����ͬ
D. CO2��Ħ����������CO2����Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�2���绯ѧװ�õ�������ȷ���ǣ� �� 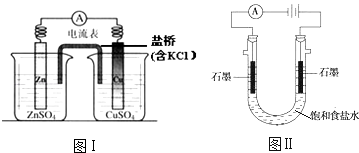
A.ͼ�����γɵ����������ǣ�����Zn��2e���TZn2+ �� ���Ӿ�������������������Cu2++2e���TCu
B.ͼ���ڲ��ı��ܷ�Ӧ��ǰ���£�����Na2SO4�滻ZnSO4 �� ��ʯī�滻Cu��
C.ͼ��ͨ���H+��Na+�ȴ��������ƶ���������Ȼ�������ŷ�����Ӧ2H++2e���TH2��
D.ͼ��ͨ�������OH��������Ǩ�ƣ�������������pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2SO4��Һ��KOH��Һ��Ӧʱ�������ų�����֪��Ӧ���������ΪE1���������������ΪE2���Իش�����������
��1�������ӷ���ʽ��ʾ�кͷ�Ӧ��ʵ�� ��
��2���ж�E1��E2�Ĵ�С��ϵ��E1 E2��
��3����֪H+(aq)+OH(aq)![]() H2O(l) ��H=57.3 kJ/mol�����������кͷ�Ӧ�зų���������
H2O(l) ��H=57.3 kJ/mol�����������кͷ�Ӧ�зų���������
����20 g NaOH���ϡ��Һ������ϡ���ᷴӦ���ܷų� kJ��������
����0.1 mol Ba(OH)2���ϡ��Һ������ϡ���ᷴӦ���ܷų� kJ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ�����о�Na2CO3��NaHCO3�����ʼ��ת����
��1���ֱ���Ũ�Ⱦ�Ϊ0.1mol/LNa2CO3��NaHCO3��Һ�еμӼ��η�̪�Լ���
��Na2CO3��Һ����ɫ��Ϊ��ɫ����ԭ���� ��
��NaHCO3��ҺҲ����ɫ��Ϊ��ɫ����ԭ���� ��
�۱Ƚ�������Һ����ɫ����ɫ��dz�������ѧʽ����
��2���о�NaHCO3��CaCl2�ķ�Ӧ��
ʵ����� | ʵ����� | ʵ������ |
ʵ��1 | ��2mL 0.001mol/L NaHCO3��Һ�м���1mL 0.1mol/LCaCl2��Һ | �����Ա仯���ü�������䣬û�г��ֹ�����ͨ·�� |
ʵ��2 | ��2mL 0.1mol/L NaHCO3��Һ�м���1mL 0.1mol/LCaCl2��Һ | ����ɫ���ȵĻ��ǣ��ü�������䣬���ֹ�����ͨ·�� |
��ʵ��1��û�г��ְ�ɫ���ǵ�ԭ���� ��
��ʵ��2���γɵķ�ɢϵ���� ��
�������ӷ���ʽ��ʾʵ��2�з����ķ�Ӧ ��
��3���ڲ������������ʵ�ǰ���£�ʵ��Na2CO3��NaHCO3֮���ת��������ͼ�б�����õ��Լ������������ʵ�Ũ�ȣ���Ӧǰ����Һ����ı仯�ɺ��ԣ��� 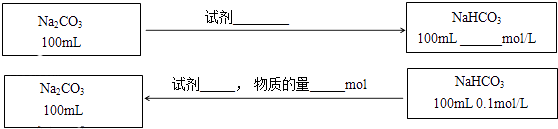
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ij��Һ�еμ�Ba(OH)2 ��Һʱ�����������ʵ�����Ba(OH)2 �����ʵ����ı仯��ϵ������Һ�ijɷֿ�����
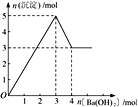
A. MgSO4 B. Al2 (SO4 )3 C. Fe2 (SO4 )3 D. NaAlO2
���𰸡�B
��������A��������þ����������������Һ���������������ټ�����������Һ�����������䣬A����B����ͼ��֪�ܽ�����������Ҫ1mol������������Al(OH)3��OH��===AlO2����2H2O��֪������Al(OH)3Ϊ2mol����Al2(SO4)3Ϊ1mol������3mol���������������������ᱵ3mol��n��Al3+����n��OH-��=2mol��6mol=1��3��������ӦAl3����3OH��===Al(OH)3�������Եõ�2molAl(OH)3������Ϊ3mol+2mol=5mol��B��ȷ��C��������������������Һ��Ӧ����������������������������������������������������ټ�����������Һ�������������䣬��ͼ��һ�£�C����D��ƫ��������������������Ӧ�����ܲ���������D����ѡB��
�㾦��������ͼ��Ϊ���忼��þ������������ʣ���ȷ�����Ļ�ѧ��Ӧ�ǽ��Ĺؼ�����Ӧ�������Ⱥ�˳����ѧ������е��ѵ㣬ע��ͼ�������ϵ��ע���������������ص㡣
�����͡���ѡ��
��������
15
����Ŀ����ͼ��ʾ����MgCl2��AlCl3�Ļ����Һ�м���NaOH��Һ������ʱ���������ʵ���y mol�����NaOH��Һ����������x mL�Ĺ�ϵͼ������ͼʾ�жϣ����н����в���ȷ����
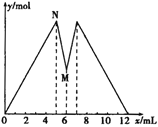
A. N��ʱ��Һ�е�����ֻ��NaCl
B. ԭ�����Һ��c (MgCl2)��c (AlCl3)=1��2
C. c (NaOH)=c (HCl)
D. M��֮ǰ�������NaOH��Һ��M��֮������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�з�Ӧ��Cu2O+2H+=Cu+Cu2++H2O�������������������ԭCuO���õĺ�ɫ�������Ƿ�Cu2O���Լ���(����)
A.ϡ����B.ϡ����C.����D.Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������͵����������Ǵ�������Ҫ��Ⱦ���ֹ��������Ի�������Ⱦ�ǵ�ǰ������������Ҫ�о�����֮һ��
��1��һ�������£�������Ӧ2SO2��g��+O2��g��2SO3��g������2L�ܱ�������ͨ��2mol SO2��g����1mol O2��g����0.2mol SO3��g����2min��Ӧ�ﵽƽ��ʱ�����SO2�����ʵ���Ϊ1mol����ÿ��淴Ӧ��ƽ�ⳣ��K=�������£������������ټ���2mol SO2��g���������´ﵽƽ��ʱSO2����ת���� 0%�����������������=������
��2����һ�ܱ������з�����Ӧ2NO22NO+O2��H��0����Ӧ������NO2��Ũ����ʱ��仯�������ͼ��ʾ��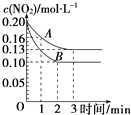
��ش�
��������A����Ӧ��ǰ3min��������ƽ����Ӧ����Ϊ ��
��������A��B�ֱ��ʾ���Ǹ÷�Ӧ��ij��ͬ�����µķ�Ӧ���������������������Ũ�ȡ�����ѹǿ�������¶ȡ�����������
��3��һ���¶��£����ܱ�������N2O5�ɷ������з�Ӧ��
��2N2O5��g��4NO2��g��+O2��g��
��2NO2��g��2NO��g��+O2��g��
����ƽ��ʱ��c��NO2��=0.4molL��1 �� c��O2��=1.3molL��1 �� ��Ӧ����NO2��ת����Ϊ �� N2O5��g������ʼŨ��Ӧ������ molL��1 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com