
【题目】H2SO4溶液和KOH溶液反应时有热量放出,已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题:
(1)用离子方程式表示中和反应的实质 。
(2)判断E1和E2的大小关系:E1 E2。
(3)已知H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
①用20 g NaOH配成稀溶液与足量稀盐酸反应,能放出 kJ的热量。
②用0.1 mol Ba(OH)2配成稀溶液跟足量稀硝酸反应,能放出 kJ的热量。
科目:高中化学 来源: 题型:
【题目】将 8gSO3 加入 Xg 水中,所形成的溶液里,SO42-和水分子个数之比为 1∶5,则 X 等于( )
A. 9 B. 10.8 C. 12.4 D. 15.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极. 
(1)b极反应式为 , a极反应式为 , C电极反应式为 .
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 , 此时要恢复原溶液的浓度需加入(填化学式).
(3)若将装置B改为电解精炼铜,则粗铜作极,阴极反应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1molL﹣1NaOH溶液滴定0.1molL﹣1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL〕.继续加水至50mL,所得溶液的pH是( )
A.4
B.7.2
C.10
D.11.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下实验,探究化学反应中的热效应,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管往其中滴加5 mL盐酸。
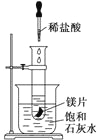
试回答下列问题:
(1)实验中观察到的现象是_____________________________________________。
(2)产生上述现象的原因是____________________________________________。
(3)写出有关反应的离子方程式______________________________________。
(4)由实验推知,MgCl2和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25℃的饱和石灰水”换成“20℃碳酸饮料”进行实验探究,实验中观察到的另一现象是________________________________________________________________,其原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
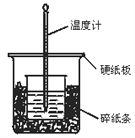
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)烧杯间填满碎纸条的作用是________________________;
(3)大烧杯上如不盖硬纸板,求得的中和热数值_____(填“偏大”“偏小”“无影响”);
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),简述理由______________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下措施都能使海洋钢质钻台增强抗腐蚀能力,其中属于“牺牲阳极的阴极保护法”的是( )
A.对钢材“发蓝”(钝化)B.选用铬铁合金
C.外接电源负极D.连接锌块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)常温下,0.05mol/L硫酸溶液中,pH值为 , 水电离出的c(H+)=mol/L.
(2)某温度时,测得0.01molL﹣1的NaOH溶液的pH为11,则该温度下水的离子积常数为
在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合.
①若所得混合液为中性,且a=2,b=12,则Va:Vb= .
②若所得混合液的pH=10,且a=2,b=12,则Va:Vb=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中加入足量Na2O2后,仍能大量共存的一组离子是( )
A.K+、AlO2﹣、Cl﹣、SO42﹣
B.Fe2+、HCO3﹣、K2、SO42﹣
C.Na+、Cl﹣、AlO2﹣、NO3﹣
D.NH4+、NO3﹣、I﹣、CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com