
【题目】用0.1molL﹣1NaOH溶液滴定0.1molL﹣1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL〕.继续加水至50mL,所得溶液的pH是( )
A.4
B.7.2
C.10
D.11.3
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】工业上为了处理含有Cr2O ![]() 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量已低于排放标准.关于上述方法,下列说法错误的是( )
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量已低于排放标准.关于上述方法,下列说法错误的是( )
A.阳极反应:Fe﹣2e﹣═Fe2+
B.阴极反应:2H++2e﹣═H2↑
C.在电解过程中工业废水由酸性变为碱性
D.可以将铁电极改为石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol MgCl2中含有 ( )
A. 3.01×1023个Mg2+B. 6.02×1023个Cl-
C. 1 mol Mg2+D. 1 mol Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol CO2 的质量为44g/mol
B. CO2的摩尔质量为44g
C. NA个CO2的质量与CO2的相对分子质量在数值上相同
D. CO2的摩尔质量等于CO2的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知: | |
步骤: | 现象: |
A.该反应是一个氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应
C.该实验不能证明减小生成物浓度,平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是( ) 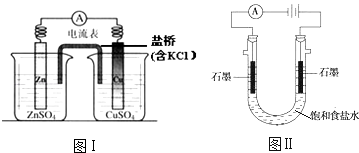
A.图Ⅰ,电流形成的完整过程是:负极Zn﹣2e﹣═Zn2+ , 电子经导线流向正极,正极Cu2++2e﹣═Cu
B.图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4 , 用石墨替换Cu棒
C.图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e﹣═H2↑
D.图Ⅱ,通电后,由于OH﹣向阳极迁移,导致阳极附近pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SO4溶液和KOH溶液反应时有热量放出,已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题:
(1)用离子方程式表示中和反应的实质 。
(2)判断E1和E2的大小关系:E1 E2。
(3)已知H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
①用20 g NaOH配成稀溶液与足量稀盐酸反应,能放出 kJ的热量。
②用0.1 mol Ba(OH)2配成稀溶液跟足量稀硝酸反应,能放出 kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2 溶液时,沉淀的物质的量随Ba(OH)2 的物质的量的变化关系。该溶液的成分可能是
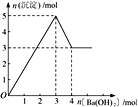
A. MgSO4 B. Al2 (SO4 )3 C. Fe2 (SO4 )3 D. NaAlO2
【答案】B
【解析】A、氢氧化镁不溶于氢氧化钡溶液,沉淀量达最大后,再加氢氧化钡溶液,沉淀量不变,A错误;B、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-===AlO2-+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH-)=2mol:6mol=1:3,发生反应Al3++3OH-===Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,B正确;C、硫酸铁与氢氧化钡溶液反应生成氢氧化铁,氢氧化铁不溶于氢氧化钡,则沉淀量达最大后,再加氢氧化钡溶液,沉淀的量不变,与图象不一致,C错误;D、偏铝酸钠与氢氧化钡不反应,不能产生沉淀,D错误;答案选B。
点睛:本题以图象为载体考查镁铝化合物的性质,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系,注意氢氧化铝两性特点。
【题型】单选题
【结束】
15
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是
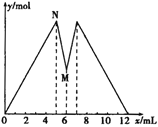
A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A图是课本中“四种基本反应类型与氧化还原反应的关系”图,A图中用I~IV阴影部分表示反应所属的区域正确的是
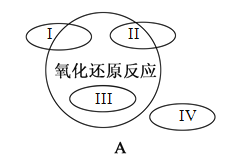
A. 粗硅提纯:Si(粗)+3HCl![]() SiHCl3+H2 所属区域可能是I或II
SiHCl3+H2 所属区域可能是I或II
B. 金属钠在空气中燃烧:2 Na + O2 ![]() Na2O2 所属的区域一定是III
Na2O2 所属的区域一定是III
C. 实验室制取氯气:4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O所属的区域可能是III
MnCl2+Cl2↑+2H2O所属的区域可能是III
D. 土法制碱:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 所属的区域一定是IV
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com