
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知: | |
步骤: | 现象: |
A.该反应是一个氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应
C.该实验不能证明减小生成物浓度,平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是温度
【答案】C
【解析】解:A.反应中元素化合价没有变化,不属于氧化还原反应,故A错误;
B.试管b中溶液颜色不变的目的是使反应到达平衡,且可逆反应中反应物不能完全转化,故B错误;
C.加入氢氧化钠溶液,可能是增大氢氧根离子浓度使平衡正向移动,不能证明减小生成物浓度使平衡正向移动,故C正确;
D.增大氢离子浓度、温度升高均使平衡逆向移动,无法说明影响平衡的主要因素是温度,故D错误,
故选:C.
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】酸雨形成的示意图如图.下列说法中,不正确的是( ) 
A.汽车尾气是导致酸雨的原因之一
B.酸雨会使土壤、湖泊酸化
C.酸雨形成中不涉及氧化还原反应
D.燃煤中加入石灰石可防治酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀溶液中,强酸与强碱反应的中和热为57.3 kJ/mol。下列热化学方程式中正确的是
A.HNO3(aq)+KOH(aq)![]() H2O(l)+KNO3(aq) ΔH >57.3 kJ/mol
H2O(l)+KNO3(aq) ΔH >57.3 kJ/mol
B.HNO3(aq)+NH3·H2O(aq)![]() H2O(l)+NH4NO3(aq) ΔH <57.3 kJ/mol
H2O(l)+NH4NO3(aq) ΔH <57.3 kJ/mol
C.CH3COOH(aq)+KOH(aq)![]() H2O(l)+CH3COOK(aq) ΔH <57.3 kJ/mol
H2O(l)+CH3COOK(aq) ΔH <57.3 kJ/mol
D.CH3COOH(aq)+NH3·H2O(aq)![]() H2O(l)+CH3COONH4(aq) ΔH >57.3 kJ/mol
H2O(l)+CH3COONH4(aq) ΔH >57.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极. 
(1)b极反应式为 , a极反应式为 , C电极反应式为 .
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 , 此时要恢复原溶液的浓度需加入(填化学式).
(3)若将装置B改为电解精炼铜,则粗铜作极,阴极反应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1molL﹣1NaOH溶液滴定0.1molL﹣1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL〕.继续加水至50mL,所得溶液的pH是( )
A.4
B.7.2
C.10
D.11.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下实验,探究化学反应中的热效应,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管往其中滴加5 mL盐酸。
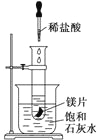
试回答下列问题:
(1)实验中观察到的现象是_____________________________________________。
(2)产生上述现象的原因是____________________________________________。
(3)写出有关反应的离子方程式______________________________________。
(4)由实验推知,MgCl2和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25℃的饱和石灰水”换成“20℃碳酸饮料”进行实验探究,实验中观察到的另一现象是________________________________________________________________,其原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下措施都能使海洋钢质钻台增强抗腐蚀能力,其中属于“牺牲阳极的阴极保护法”的是( )
A.对钢材“发蓝”(钝化)B.选用铬铁合金
C.外接电源负极D.连接锌块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色强酸性溶液中能大量共存的一组离子是
A. NH4+ 、SO42- 、Al3+ 、NO3- B. Na+ 、K+ 、HCO3-、NO3-
C. Na+ 、Ca2+ 、NO3- 、CO32- D. K+、Cu2+ 、NH4+ 、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com