
【题目】按要求填空
(1)常温下,0.05mol/L硫酸溶液中,pH值为 , 水电离出的c(H+)=mol/L.
(2)某温度时,测得0.01molL﹣1的NaOH溶液的pH为11,则该温度下水的离子积常数为
在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合.
①若所得混合液为中性,且a=2,b=12,则Va:Vb= .
②若所得混合液的pH=10,且a=2,b=12,则Va:Vb=
【答案】
(1)1;1×10﹣13
(2)1×10﹣13;10:1;9:1
【解析】解:(1)0.05mol/L硫酸溶液中,c(H+)═2c(SO42﹣)=0.1mol/L;则pH=﹣lgc(H+)=1;C(OH﹣)= ![]() =10﹣13mol/L;
=10﹣13mol/L;
所以答案是:1;10﹣13;(1)0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×10﹣11mol/L,c(OH﹣)=0.01mol/L,Kw=c(H+)×c(OH﹣)=1×10﹣13 , 所以答案是:1×10﹣13;
将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,
①若所得混合溶液为中性,且a=2,b=12,因c(H+)×Va=c(OH﹣)×Vb , a=2,b=12,则0.01Va=0.1×Vb , 则Va:Vb=10:1,所以答案是:10:1;
②若所得混合溶液的pH=10,碱过量,c(OH﹣)= ![]() =0.001,则Va:Vb=9:1,
=0.001,则Va:Vb=9:1,
所以答案是:9:1.


科目:高中化学 来源: 题型:
【题目】1 mol MgCl2中含有 ( )
A. 3.01×1023个Mg2+B. 6.02×1023个Cl-
C. 1 mol Mg2+D. 1 mol Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SO4溶液和KOH溶液反应时有热量放出,已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题:
(1)用离子方程式表示中和反应的实质 。
(2)判断E1和E2的大小关系:E1 E2。
(3)已知H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
①用20 g NaOH配成稀溶液与足量稀盐酸反应,能放出 kJ的热量。
②用0.1 mol Ba(OH)2配成稀溶液跟足量稀硝酸反应,能放出 kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2 溶液时,沉淀的物质的量随Ba(OH)2 的物质的量的变化关系。该溶液的成分可能是
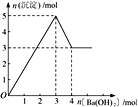
A. MgSO4 B. Al2 (SO4 )3 C. Fe2 (SO4 )3 D. NaAlO2
【答案】B
【解析】A、氢氧化镁不溶于氢氧化钡溶液,沉淀量达最大后,再加氢氧化钡溶液,沉淀量不变,A错误;B、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-===AlO2-+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH-)=2mol:6mol=1:3,发生反应Al3++3OH-===Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,B正确;C、硫酸铁与氢氧化钡溶液反应生成氢氧化铁,氢氧化铁不溶于氢氧化钡,则沉淀量达最大后,再加氢氧化钡溶液,沉淀的量不变,与图象不一致,C错误;D、偏铝酸钠与氢氧化钡不反应,不能产生沉淀,D错误;答案选B。
点睛:本题以图象为载体考查镁铝化合物的性质,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系,注意氢氧化铝两性特点。
【题型】单选题
【结束】
15
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是
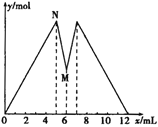
A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物不能由CH2=CH2通过加成反应制取的是( )
A. CH3CH2ClB. CH2Cl—CH2Cl
C. CH3—CH2OHD. CH3—COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有反应:Cu2O+2H+=Cu+Cu2++H2O,则可用来检验氢气还原CuO所得的红色固体中是否含Cu2O的试剂是( )
A.稀硝酸B.稀硫酸C.盐酸D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几个离子反应:
① Cr2O![]() +14H++6Cl-===2Cr3++3Cl2↑+7H2O
+14H++6Cl-===2Cr3++3Cl2↑+7H2O
② 2Fe2++Br2===2Fe3++2Br- ③ 2Br-+Cl2=== Br2+2Cl-
④ 2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
下列有关性质的比较中正确的是( )。
A. 氧化性:Cr2O![]() >Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O
>Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O![]()
C. 还原性:SO2<Fe2+<Br- D. 还原性:Cl->Cr3+>Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A图是课本中“四种基本反应类型与氧化还原反应的关系”图,A图中用I~IV阴影部分表示反应所属的区域正确的是
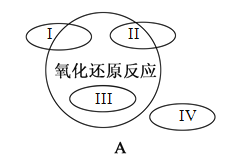
A. 粗硅提纯:Si(粗)+3HCl![]() SiHCl3+H2 所属区域可能是I或II
SiHCl3+H2 所属区域可能是I或II
B. 金属钠在空气中燃烧:2 Na + O2 ![]() Na2O2 所属的区域一定是III
Na2O2 所属的区域一定是III
C. 实验室制取氯气:4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O所属的区域可能是III
MnCl2+Cl2↑+2H2O所属的区域可能是III
D. 土法制碱:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 所属的区域一定是IV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性.在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 . 某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究.回答下列问题:
2Fe2O3+8FeCl3 . 某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究.回答下列问题: 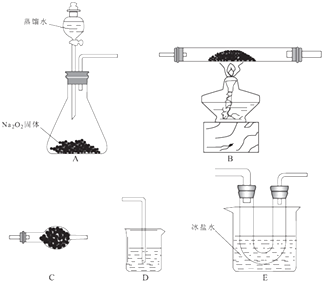
(1)装置的合理连接顺序为A、、D,其中E装置U形管左边设计为粗导管的目的是 .
(2)A装置中发生反应的化学方程式为 .
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为 .
(4)待B中充分反应后,停止加热后,还需持续通氧气至 .
(5)设计实验: ①利用E装置U形管里的固体验证Fe(OH)3是弱碱: .
②测定装置B的残留固体中铁元素的质量分数: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com