
【题目】现有下列几个离子反应:
① Cr2O![]() +14H++6Cl-===2Cr3++3Cl2↑+7H2O
+14H++6Cl-===2Cr3++3Cl2↑+7H2O
② 2Fe2++Br2===2Fe3++2Br- ③ 2Br-+Cl2=== Br2+2Cl-
④ 2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
下列有关性质的比较中正确的是( )。
A. 氧化性:Cr2O![]() >Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O
>Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O![]()
C. 还原性:SO2<Fe2+<Br- D. 还原性:Cl->Cr3+>Fe2+
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】有图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极. 
(1)b极反应式为 , a极反应式为 , C电极反应式为 .
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 , 此时要恢复原溶液的浓度需加入(填化学式).
(3)若将装置B改为电解精炼铜,则粗铜作极,阴极反应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下措施都能使海洋钢质钻台增强抗腐蚀能力,其中属于“牺牲阳极的阴极保护法”的是( )
A.对钢材“发蓝”(钝化)B.选用铬铁合金
C.外接电源负极D.连接锌块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)常温下,0.05mol/L硫酸溶液中,pH值为 , 水电离出的c(H+)=mol/L.
(2)某温度时,测得0.01molL﹣1的NaOH溶液的pH为11,则该温度下水的离子积常数为
在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合.
①若所得混合液为中性,且a=2,b=12,则Va:Vb= .
②若所得混合液的pH=10,且a=2,b=12,则Va:Vb=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质的提纯方法错误的是(括号内为杂质)( )
A.CO2(H2S):通过CuSO4溶液
B.CH3COOH(H2O):加新制生石灰,蒸馏
C.苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液
D.MgCl2溶液(Fe3+):加MgO,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。
①把FeO、Fe2O3先溶于足量的稀盐酸中、再通入适量的氯气则可制取FeCl3溶液。FeO、Fe2O3溶于足量的稀盐酸中,在上述溶液中通入适量的氯气时发生的反应的离子方程式为 ____________________。若要检验溶液中Fe3+存在应选用的试剂是_____________________。
②写出FeCl3溶液与金属铜发生反应的化学方程式___________________________________,当转移电子数为6.02×1024时,被氧化的物质的质量为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色强酸性溶液中能大量共存的一组离子是
A. NH4+ 、SO42- 、Al3+ 、NO3- B. Na+ 、K+ 、HCO3-、NO3-
C. Na+ 、Ca2+ 、NO3- 、CO32- D. K+、Cu2+ 、NH4+ 、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中加入足量Na2O2后,仍能大量共存的一组离子是( )
A.K+、AlO2﹣、Cl﹣、SO42﹣
B.Fe2+、HCO3﹣、K2、SO42﹣
C.Na+、Cl﹣、AlO2﹣、NO3﹣
D.NH4+、NO3﹣、I﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在.
(1)①氯胺(NH2Cl)的电子式为 . 可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H= .
化学键 | 键能/(kJmol﹣1) |
N﹣H | 391.3 |
Cl﹣Cl | 243.0 |
N﹣Cl | 191.2 |
H﹣Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 .
(2)用焦炭还原NO的反应为:2NO(g)+C(s)N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为(填“放热”或“吸热”)反应.
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)= .
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示: 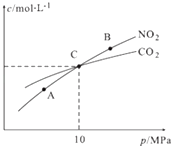
② A,B两点的浓度平衡常数关系:Kc(A)Kc(B)(填“<”或“>”或“=”).
②A,B,C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数Kp(C)=(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com