


科目:高中化学 来源:不详 题型:单选题
| A.X>Y>Z | B.Z>Y>X | C.X>Z>Y | D.Y>X>Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a > b > c > d | B.a > c > d > b |
| C.c > a > b > d | D.b > d > c > a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.铁圈和银圈左右摇摆不定 | B.保持平衡状态 |
| C.铁圈向下倾斜 | D.银圈向下倾斜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
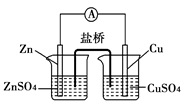
| A.电子从锌电极通过电流计流向铜电极 |
| B.盐桥中的阳离子向硫酸铜溶液中迁移 |
| C.锌电极发生氧化反应,铜电极发生还原反应 |
| D.铜电极上发生的电极反应为2H++2e-===H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水果电池是高效环保的家用电池 |
| B.锌锰干电池是一种常用的二次电池 |
| C.锌锰干电池碳棒是负极,锌片是正极 |
| D.锌锰干电池工作一段时间后锌外壳逐渐变薄 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
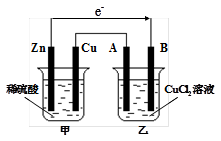
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
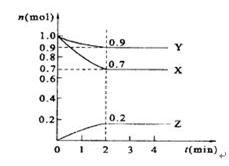
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com