
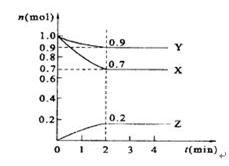
 2Z(不用可逆符号不得分); 0.05mol/(L·min); 0.45mol/L。
2Z(不用可逆符号不得分); 0.05mol/(L·min); 0.45mol/L。 2Z。
2Z。

科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
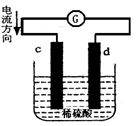
| A.电池工作的过程中,d电极上产生气泡 |
| B.电池工作时,溶液中SO42-向d移动 |
| C.c为负极,发生氧化反应 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Ni(OH) 2根据此反应式判断,此电池放电时,负极上发生反应的物质是 ( )
2Ni(OH) 2根据此反应式判断,此电池放电时,负极上发生反应的物质是 ( )| A.NiO(OH) | B.Ni(OH) 2 | C.H2 | D.H2和NiO(OH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 正极 | Zn | Cu | Zn | Cu |
| 负极 | Cu | Zn | Cu | Zn |
| 电解质溶液 | CuCl2 | CuCl2 | ZnCl2 | ZnCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
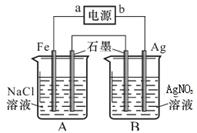
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com