
【题目】下列关于炔烃的说法中正确的是
A.分子中的碳原子不可能在同一直线上
B.分子中碳碳三键中的三个键的性质完全相同
C.分子组成符合CnH2n—2(n≥2)的链烃一定是炔烃
D.随着碳原子数增加,分子中碳的质量分数逐渐降低
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.在水溶液中橙色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈________色,因为_________________。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈_____色,因为________。
Ⅱ.现有浓度均为0.1 mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中c(H+)分别为x1 mol/L、x2 mol/L、x3 mol/L,则它们的大小关系为_______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,消耗NaOH的物质的量依次为y1 mol、y2 mol、y3 mol,则它们的大小关系为______。
(3)在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
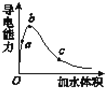
①a、b、c三点醋酸电离程度由大到小的顺序为____;a、b、c三点对应的溶液中c(H+)最大的是_____。
②若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=____。
③在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(__)。
A.c(H+) B.溶液pH C.![]() D. CH3COOH分子数
D. CH3COOH分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八角油是良好的天然香料和食品调料,其主要成分茴香脑的结构简式如图所示。下列关于苗香脑的说法错误的是
![]()
A.难溶于水,易溶于乙酸乙酯
B.属于烃的衍生物,与![]() 互为同系物
互为同系物
C.1mol 该分子最多能与4mol H2发生加成反应
D.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是__填序号。
a.烃A和烃B可能互为同系物
b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃
d.当n=11时,烃B可能的分子式有2种
(2)若烃A为链烃,且分子中所有碳原子都任同一条直线上,则A的结构简式为__。
(3)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1molA最多可与1molH2加成,则A的名称是__。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加1.26g,再通过足量的碱石灰,碱石灰的质量增加4.4g,则烃B的分子式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 为原子序数依次增大的短周期主族元素。元素W 分别与元素 X、Y、Z 结合形成质子数相同的甲、乙、丙三种分子。反应②是工业制硝酸的重要反应,乙与丙的混合物不能用玻璃瓶盛装。上述物质有如图所示的转化关系:
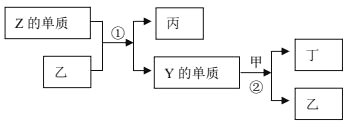
下列说法错误的是
A.甲是易液化气体,常用作致冷剂
B.可以用甲在一定条件下消除丁对环境的污染
C.甲、丙分子可以直接化合生成离子化合物
D.丁是一种红棕色气体,是大气主要污染物之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治疗帕金森病的新药沙芬酰胺的合成方法如下:

已知:
①CH3CN 在酸性条件下可水解生成 CH3COOH。
②CH2=CH-OH 和 CH3OOH 均不稳定。
(1)C 生成 D 的反应类型为_______________。G中含氧官能团的名称为_____。B 的名称为_____。
(2)沙芬酰胺的结构简式为_____。
(3)写出反应(1)的方程式_____。分析反应(2)的特点,写出用福尔马林浸制生物标本的反应原理的方程式_____(蛋白质的结构用![]() 表示)。
表示)。
(4)H 是 F 相邻的同系物,H 的苯环上有两个处于对位的取代基,符合下列条件的 H 的稳定的同分异构体共有_____种。
①苯环上仍然有两个处于对位的取代基;
②能与 NaOH 溶液反应;
(5)下图是根据题中信息设计的由丙烯为起始原料制备 B 的合成路线,在方框中补全必要的试剂和中间产物的结构简式(无机试剂任选,氧化剂用[O]表示,还原剂用[H]表示,连 续氧化或连续还原的只写一步)。________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
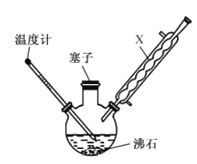
【题目】某同学在实验室以苯胺(密度:1.02g.mL—1)和浓硫酸为原料制备对氨基苯磺酸(![]() ),反应原理以及反应装置(加热及夹持仪器已省略)如下:
),反应原理以及反应装置(加热及夹持仪器已省略)如下:
![]() +H2SO4(浓)
+H2SO4(浓)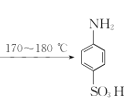 +H2O
+H2O
已知:100mL水在20C时可溶解对氨基苯磺酸1.08g,在100C时可溶解6.67g 。实验步骤:
I.在100mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入20mL浓硫酸;
II.将三颈烧瓶置于加热装置中缓慢加热至170~180℃,维持此温度2~2.5h;
III.将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到对氨基苯磺酸粗产品;
VI.将粗产品用沸水溶解,冷却结晶,抽滤,收集产品,晾干得到16.2g对氨基苯磺酸。
回答下列问题:
(1)装置中,x的名称为______________ ,其作用是__________________ 。
(2)步骤II中,“加热装置”是 ________ (填“油浴”或“水浴”)装置。
(3)步骤III中,需用少量冷水洗涤对氨基苯磺酸粗产品的原因是________________ 。
(4)步骤VI,冷却结晶过程中,若溶液颜色过深,可用__________(填一种吸附剂)脱色。
(5)本实验中对氨基苯磺酸的产率为__________(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,分别取10 mL pH均为2的盐酸、醋酸溶液分别与10mL 0.01 mol L-1 NaHCO3溶液混合,实验测得产生CO2气体的体积(V)随时间(t)的变化如图所示。下列说法不正确的是
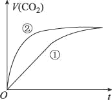
A.①表示的是盐酸的反应曲线
B.混合后的溶液中:c(CH3COO-)>c(C1-)
C.上述混合前三种溶液中水的电离程度:NaHCO3溶液>醋酸溶液=盐酸
D.醋酸和NaHCO3溶液混合后,所得的溶液中:c(CH3COO-)+ c(CH3COOH) = 0.005 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨广泛用于冶金、机械、建筑、电子等领域。以黑钨精矿为原料冶炼钨的流程如图所示:
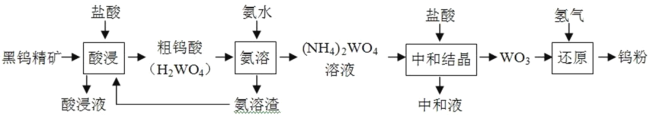
请回答下列问题。
(1)“酸浸液”中含有 Fe3+、Fe2+等金属离子,检验其中的 Fe2+常使用铁氰化钾溶液,反应的离子方程式 为_____。
(2)“氨溶”时需加热,但应控制温度不超过 70℃的原因为_____。
(3)“中和结晶”时(NH4)2WO4 与盐酸反应生成 WO3 的化学方程式为_____,所得“中和 液”的主要溶质的电子式为_____。
(4)流程图中设计将“氨溶渣”返回“酸浸”过程的目的为__________。
(5)钨钛合金在工业中应用广泛, NH4Fe(SO4)2 滴定法可测定合金中钛的含量:称取 w g 钨钛合金,用 HNO3-HF混合液溶解,用 NaOH 溶液沉淀并分离钛元素后加盐酸溶解,用金属铝将 Ti4+还原为 Ti3+,向溶液中加几滴 KSCN 作指示剂,用 c mol/L 的 NH4Fe(SO4)2 标准溶液滴定至溶液显红色,消耗标准溶液的体积为 V mL。
①滴定时发生反应的离子方程式是_____;
②样品中钛的含量为_____%(用含 w、c、V 的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com