
【题目】Ⅰ.在水溶液中橙色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈________色,因为_________________。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈_____色,因为________。
Ⅱ.现有浓度均为0.1 mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中c(H+)分别为x1 mol/L、x2 mol/L、x3 mol/L,则它们的大小关系为_______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,消耗NaOH的物质的量依次为y1 mol、y2 mol、y3 mol,则它们的大小关系为______。
(3)在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
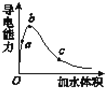
①a、b、c三点醋酸电离程度由大到小的顺序为____;a、b、c三点对应的溶液中c(H+)最大的是_____。
②若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=____。
③在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(__)。
A.c(H+) B.溶液pH C.![]() D. CH3COOH分子数
D. CH3COOH分子数
【答案】黄 加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO42—)增大,c(Cr2O72—)减小 橙 加入适量的稀硫酸,使c(H+)增大,平衡左移,c(CrO42—)减小,c(Cr2O72—)增大 x2>x1>x3 y2>y1=y3 c>b>a b 10-6 BC
【解析】
Ⅰ.(1)加入少量NaOH固体,中和了氢离子,氢离子浓度降低,据此分析判断;
(2)加入酸,H+浓度增大,据此分析判断;
Ⅱ.(1)盐酸是一元强酸,硫酸是二元强酸,完全电离,醋酸是一元弱酸,不能完全电离,据此分析判断;
(2)等体积的浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同,与NaOH反应生成盐的物质的量相同,据此分析判断;
(3)①醋酸是弱电解质,加水稀释,促进醋酸电离;导电能力越强,说明溶液中的离子浓度越大;②电离平衡常数Ka=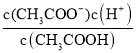 进行计算;③加水稀释,促进醋酸电离,n(CH3COO-)、n(H+)增大,但浓度减小,以此分析判断。
进行计算;③加水稀释,促进醋酸电离,n(CH3COO-)、n(H+)增大,但浓度减小,以此分析判断。
Ⅰ.(1)加入少量NaOH固体,中和了氢离子,氢离子浓度降低,Cr2O72-+H2O![]() 2CrO42-+2H+平衡向右移动,溶液呈黄色,故答案为:黄;加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO42-)增大,c(Cr2O72-)减小;
2CrO42-+2H+平衡向右移动,溶液呈黄色,故答案为:黄;加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO42-)增大,c(Cr2O72-)减小;
(2)加入过量稀硫酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙色,故答案为:橙红;加入适量的稀硫酸,使c(H+)增大,平衡左移,c(CrO42-)减小,c(Cr2O72-)增大;
Ⅱ.(1)盐酸是一元强酸,硫酸是二元强酸,都能够完全电离,醋酸是一元弱酸,不能完全电离,所以浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液中,氢离子浓度分别为0.1molL-1、0.2molL-1、小于0.1molL-1,所以![]() x1=x2>x3(或x2>x1>x3),故答案为:
x1=x2>x3(或x2>x1>x3),故答案为:![]() x1=x2>x3(或x2>x1>x3);
x1=x2>x3(或x2>x1>x3);
(2)等体积的浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同,所以其与NaOH反应生成盐的物质的量相同,但硫酸为二元酸,消耗的氢氧化钠的体积为其余两种酸的体积的2倍,即y2>y1=y3(或y2=2y1=2y3)故答案为:y2>y1=y3(或y2=2y1=2y3);
(3)①醋酸是弱电解质,所以醋酸溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液体积越大,醋酸的电离程度越大,根据图像知,水的体积越大,溶液的浓度越小,醋酸的电离程度越大,所以醋酸电离程度大小顺序是c>b>a;溶液的导电能力与离子浓度成正比,所以溶液导电能力越大氢离子浓度越大,则氢离子浓度最大的为b,故答案为:c>b>a;b;
②经实验测得c点处:c(CH3COOH)=0.01molL-1,c(CH3COO-)=0.0001molL-1,则该条件下CH3COOH的电离常数Ka=![]() =1.0×10-6 mol/L,故答案为:1.0×10-6;
=1.0×10-6 mol/L,故答案为:1.0×10-6;
③A.在稀释过程中,溶液的体积增大,氢离子的浓度减小,故A错误;B.在稀释过程中,溶液的体积增大,氢离子的浓度减小,溶液pH增大,故B正确;C.加水稀释,促进电离,n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,则 增大,故C正确;D.醋酸的浓度越小,电离程度越大,平衡向右移动,CH3COOH分子数减少,故D错误;故答案为:BC。
增大,故C正确;D.醋酸的浓度越小,电离程度越大,平衡向右移动,CH3COOH分子数减少,故D错误;故答案为:BC。


科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象、解释或结论都正确的是![]()
![]()
选项 | 实验操作 | 现象 | 解释或结论 |
A | 等体积 | HX放出的氢气多 | HX酸性比HY弱 |
B | 先向 | 开始有白色沉淀生成;后又有黑色沉淀生成 |
|
C | Al箔插入稀 | 无现象 | Al箔表面被 |
D | 向紫色石蕊试液中持续长时间通入氯气 | 溶液先变红,最后变为无色 | 氯气有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与碱金属等单质在较高温度下可以化合形成离子型金属氢化物,如NaH、LiH等,它们具有极强的还原性,也是良好的野外生氢剂(NaH+H2O=NaOH+H2↑),下列说法不正确的是
A.金属氢化物具有强还原性的原因是其中的氢元素为-l价
B.NaH的电子式可表示为Na+[:H]-
C.NaAlH4与水反应:NaAlH4+H2O=NaOH+Al(OH)3+H2↑
D.工业上用有效氢含量衡量含氢还原剂的供氢能力,有效氢指单位质量(克)的含氢还原剂的还原能力相当于多少克氢气的还原能力。则LiAlH4的有效氢含量约为0.21
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是

A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中关于能量的比较正确的是( )
①CH3OH(g)+O2(g)=CO (g)+2H2O(l) △H1;CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H2; △H1<△H2
②2H2O(l) =2H2(g)+O2(g) △H1; 2Na(s)+2H2O(l) =2NaOH(aq)+H2(g) ΔH2; △H1>△H2
③H2(g)+Cl2(g)=2HCl(g) △H1; ![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl (g) △H2; △H1>△H2
Cl2(g)=HCl (g) △H2; △H1>△H2
④t ℃时,在一定条件下,将 1 mol N2和 3 mol H2 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为 Q1、Q2 ; Q1<Q2
A.①③B.②④C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。煤干馏后可得到焦炭、煤焦油、粗氨水和焦炉气等。焦炭可通过以下途径制取聚氯乙烯等化工产品。
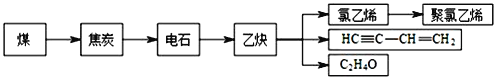
完成下列填空:
(1)石油化工生产乙烯的操作名称为___,乙炔的分子空间构型是____,由乙炔生产HC≡C-CH=CH2的基本反应类型是___。在石油生产乙烯的过程中会产生副产品异戊烯,通过催化脱氢法得到异戊二烯,进而通过1,4-加聚反应得到异戊橡胶,由异戊二烯生产异戊橡胶的化学方程式为:___。
(2)乙炔可用来合成聚氯乙烯。请以乙炔为原料,无机试剂任选,设计聚氯乙烯的合成路线。____
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁储量居世界首位。含Fe2O3的钛铁矿(主要成分为FeTiO3)制备TiO2流程如下:

(1)步骤①加Fe的目的是__;步骤②冷却的目的是__。
(2)上述制备TiO2的过程中,可以利用的副产物是__;考虑成本和废物综合利用因素,废液中应加入___处理。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的步骤为
![]() →
→![]()
![]()
![]()
反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3A(g)+B(g) = 2C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(C)=0.8 mol /(L·s)B.v(B)=0.3 mol/(L·s)
C.v(A)=0.5 mol /(L·s)D.v(D)=1 mol /(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com