
����Ŀ�������й�ʵ������������ͻ���۶���ȷ����![]()
![]()
ѡ�� | ʵ����� | ���� | ���ͻ���� |
A | ����� | HX�ų��������� | HX���Ա�HY�� |
B | ���� | ��ʼ�а�ɫ�������ɣ������к�ɫ�������� |
|
C | Al������ϡ | ������ | Al�����汻 |
D | ����ɫʯ����Һ�г�����ʱ��ͨ������ | ��Һ�ȱ�죬����Ϊ��ɫ | ������Ư���� |
A.AB.BC.CD.D
 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ��������õ������� KAl(SO4)2��12H2O�����������Ʊ�Al��K2SO4��H2SO4�Ĺ��չ���������ʾ��
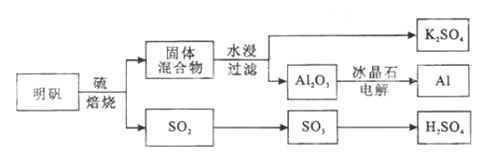
���������Ļ�ѧ����ʽΪ��4KAl(SO4)2��12H2O+3S��2K2SO4+2Al2O3+9SO2+48H2O
��ش��������⣺
��1���ڱ��������ķ�Ӧ�У���ԭ����__________________��
��2����ˮ�������Һ�еõ�K2SO4����ķ�����_____________________��
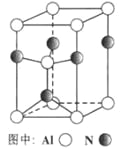
��3��A12O3��һ�������¿��Ƶ�AIN���侧��ṹ����ͼ��ʾ���þ�����Al����λ����____��
��4����Al��NiO(OH)Ϊ�缫��NaOH��ҺΪ���Һ���һ�����͵�أ��ŵ�ʱNiO(OH)ת��ΪNi(OH)2���õ�ط�Ӧ�Ļ�ѧ����ʽ��_____________________________��
��5�����ղ�����SO2�����������ᡣ��֪25�桢101 kPaʱ��
2SO2(g) +O2(g)![]() 2SO3(g) ��H1= һ197 kJ/mol��
2SO3(g) ��H1= һ197 kJ/mol��
2H2O (g)��2H2O(1) ��H2��һ44 kJ/mol��
2SO2(g)+O2(g)+2H2O(g)��2H2SO4(l) ��H3��һ545 kJ/mol��
��SO3(g)��H2O(l)��Ӧ���Ȼ�ѧ����ʽ��__________________________��
����948t����(M��474 g/mol )����SO2��������Ϊ96%����������������Ϊ98��������________t��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ��ʱ�õ�һ�ֱ��������ᄃ�壬�ṹ��ͼ��ʾ���й�˵������ȷ���ǣ�������

A. �þ����������Ӿ���
B. ����Ļ�ѧʽΪBa2O2
C. �þ��徧���ṹ��NaCl����
D. ��ÿ��Ba2+��������������Ba2+����12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.![]() ��һ������
��һ������ ��һ����ﶼ��4��
��һ����ﶼ��4��![]() �����������칹
�����������칹![]()
B.CH3CH=CHCH3�����е��ĸ�̼ԭ����ͬһֱ����
C.��ϵͳ�������������� ��������2��3��
��������2��3��![]() ����
����![]() �һ�����
�һ�����
D.ľ�Ǵ�(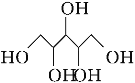 )��������(
)��������( )��Ϊͬϵ�����������
)��Ϊͬϵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���(����)
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | ֤���ǽ�����ǿ��:Cl>C>Si |
|
B | ����NaBr��KI��Һ | �ֱ��������ˮ��,��CCl4��ȡ |
C | ��ȥNaHCO3�����е�Na2CO3 | ��������������� |
D | ֤����ͬ�¶���: Ksp(Ag2S)<Ksp(AgCl) | ��2 mL 0.1 mol��L-1��������Һ�м���1 mL 0.1 mol��L-1 NaCl��Һ,���ְ�ɫ����,�ټ��� ����0.1 mol��L-1 Na2S��Һ,�к�ɫ�������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������⣺
��1������ʽΪC8H10�ķ������������ϵ�һ��ȡ����ֻ��һ�֣�д���÷������Ľṹ��ʽ��__��
��2���ۺ��� �ĵ�����___��
�ĵ�����___��
��3����Է�������Ϊ58���л�������A��1mol��������������Һ���ÿ�����4molAg������ṹ��ʽΪ��__�������л���A��������Ʒ�Ӧ������ʹ������Ȼ�̼��Һ��ɫ������л���Ľṹ��ʽ��__��(ע���ǻ�����˫��̼�ϵ��л��K���ȶ�)
��4��ʵ���ҽ�������ʵ�飺��ʯ�ͷ����Ʊ���ϩ�����Ʊ��屽 ���ܱ������������Ʊ�����������
����Ҫ���ȵ���___����Ҫˮԡ���ȵ���___����Ҫ�¶ȼƵ���___�������¶ȼƲ��뷴ӦҺ����___����Ҫ�����Ƭ����___����Ӧ�б������Ũ�������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��a��b��ʯī�缫��ͨ��һ��ʱ���b��������Һ�Ժ�ɫ������˵������ȷ���ǣ� ��
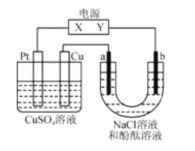
A.X���ǵ�Դ������Y���ǵ�Դ����
B.Cu�缫������6.4gʱ��b������4.48L����״��������
C.��������CuSO4��Һ��pH��С
D.a���ĵ缫��ӦʽΪ2C1--2e-=Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ˮ��Һ�г�ɫ��Cr2O72�����ɫ��CrO42��������ƽ���ϵ��Cr2O72����H2O![]() 2CrO42����2H�����ظ����(K2Cr2O7)����ˮ��ɵ�ϡ��Һ�dzȻ�ɫ�ġ�
2CrO42����2H�����ظ����(K2Cr2O7)����ˮ��ɵ�ϡ��Һ�dzȻ�ɫ�ġ�
(1)��������Һ�м���NaOH��Һ����Һ��________ɫ����Ϊ_________________��
(2)���Ѽ���NaOH��Һ��(1)��Һ���ټ������ϡ���ᣬ����Һ��_____ɫ����Ϊ________��
��.����Ũ�Ⱦ�Ϊ0.1 mol/L�����ᡢ���ᡢ����������Һ���ش��������⣺
(1)��������Һ��c(H��)�ֱ�Ϊx1 mol/L��x2 mol/L��x3 mol/L�������ǵĴ�С��ϵΪ_______��
(2)�����������������ֱ��������NaOH��Һ��Ӧ������NaOH�����ʵ�������Ϊy1 mol��y2 mol��y3 mol�������ǵĴ�С��ϵΪ______��
(3)��һ���¶��£���������м�ˮϡ�ͣ���Һ���������仯���ͼ��ʾ���ش��������⡣
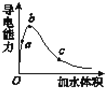
��a��b��c����������̶��ɴ�С��˳��Ϊ____��a��b��c�����Ӧ����Һ��c(H��)������_____��
����ʵ����c�㴦��Һ��c(CH3COOH)��0.01 mol��L��1��c(CH3COO��)��0.0001 mol��L��1�����������CH3COOH�ĵ��볣��Ka��____��
����ϡ�����У����Ŵ���Ũ�ȵĽ��ͣ�����ʼ�ձ����������Ƶ�������__����
A��c(H��) B����ҺpH C��![]() D. CH3COOH������
D. CH3COOH������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com