
【题目】下列各组反应中关于能量的比较正确的是( )
①CH3OH(g)+O2(g)=CO (g)+2H2O(l) △H1;CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H2; △H1<△H2
②2H2O(l) =2H2(g)+O2(g) △H1; 2Na(s)+2H2O(l) =2NaOH(aq)+H2(g) ΔH2; △H1>△H2
③H2(g)+Cl2(g)=2HCl(g) △H1; ![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl (g) △H2; △H1>△H2
Cl2(g)=HCl (g) △H2; △H1>△H2
④t ℃时,在一定条件下,将 1 mol N2和 3 mol H2 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为 Q1、Q2 ; Q1<Q2
A.①③B.②④C.③④D.①④
【答案】B
【解析】
①CO能够燃烧放出热量,所以乙醇燃烧生成CO比生成二氧化碳放热少,放出的热量越多,△H越小,则△H1>△H2,故①错误;
②H2O分解为吸热反应,则2H2O(l)=2H2(g)+O2(g)△H1>0;Na与H2O反应为放热反应,则2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H2<0,所以△H1>△H2,故②正确;
③氯气和氢气的化合为放热反应,所以焓变为负值,又焓变与系数成正比,所以H2(g)+Cl2(g)=2HCl(g)△H1;![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)△H2;△H1<△H2,故③错误;
Cl2(g)=HCl(g)△H2;△H1<△H2,故③错误;
④因为1molN2和3molH2反应生成氨气为气体体积减小的可逆反应,所以恒容相对于在恒压的基础上增大体积即减小压强,平衡逆向移动,则放出热量减小,所以Q1<Q2,故④正确;
正确的有②④,故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和 的一溴代物都有4种
的一溴代物都有4种![]() 不考虑立体异构
不考虑立体异构![]()
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物 的名称是2,3,
的名称是2,3,![]() 三甲基
三甲基![]() 乙基戊烷
乙基戊烷
D.木糖醇( )和葡萄糖(
)和葡萄糖( )互为同系物,均属于糖类
)互为同系物,均属于糖类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时铜电极质量增加2.16g,试回答(硝酸银足量):
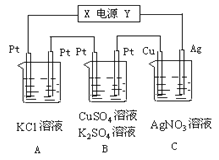
(1)电源电极X名称为____。
(2)通电5min时,B中共收集到224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为____。
(3)若A中KCl溶液的体积也是200mL(KCl足量,不考虑氯气的溶解),电解后溶液的c(OH-) =____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是

A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )

A.氢氧化钠的物质的量浓度为1 mol·L-1
B.曲线b是氢氧化钠滴定盐酸的滴定曲线
C.P点时反应恰好完全,溶液呈中性
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在水溶液中橙色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈________色,因为_________________。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈_____色,因为________。
Ⅱ.现有浓度均为0.1 mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中c(H+)分别为x1 mol/L、x2 mol/L、x3 mol/L,则它们的大小关系为_______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,消耗NaOH的物质的量依次为y1 mol、y2 mol、y3 mol,则它们的大小关系为______。
(3)在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
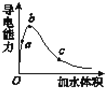
①a、b、c三点醋酸电离程度由大到小的顺序为____;a、b、c三点对应的溶液中c(H+)最大的是_____。
②若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=____。
③在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(__)。
A.c(H+) B.溶液pH C.![]() D. CH3COOH分子数
D. CH3COOH分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列说法中不正确的是 ( )
A. “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致.
B. 加入Na2S可消除污水中Hg2+ 的污染。
C. 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含量是空气质量报告的主要项目
D. 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH![]()
![]() ,其过程符合绿色化学的原则
,其过程符合绿色化学的原则
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废气中的SO2经如下图中的两个循环可分别得到S和H2SO4,假设循环I、II处理等质量的SO2。下列说法正确的是

A. “反应1”和“电解”中的氧化产物分别是ZnFeO3.5和MnO2
B. “反应2”和“吸收”中的SO2均起还原剂的作用
C. 铁网或石墨均可作为循环II中电解过程中的阳极材料
D. 循环I、II中理论上分别得到S和H2SO4的物质的量比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com