
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是

A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
【答案】B
【解析】
该化合物由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子,且X、Y、Z、M均为短周期元素,均不在同一族,由结构图并结合X、Y、Z、M可知X为H元素、Y为O元素、Z为N元素,M为Cl元素,化合物中含有NH4+、H3O+、N5-和Cl-,则:
A.H2O分子之存在氢键,其沸点明显高于O族其它元素的氢化物,如H2S等,故A正确;
B.Cl的非金属性比N强,则HNO3的酸性比HClO4弱,故B错误;
C.O的非金属性比N强,则H2O比NH3稳定,故C正确;
D.该盐中含有NH4+、H3O+、N5-,其中NH4+、H3O+中均含有极性共价键,而N5-中的N-N键为非极性键,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于乙醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。其阴离子的结构如图所示: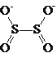 。某科研小组制备并探究其性质。
。某科研小组制备并探究其性质。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)
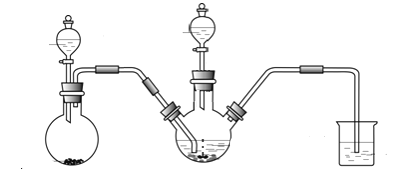
(1)Na2S2O4中硫元素的化合价为_______。
(2)连接好装置后,检查其气密性良好的操作是____________________。
(3)添加药品、再次连接好装置:
①第一步,将A中生成的气体通往B中进行反应,在B装置生成连二亚硫酸锌的化合反应方程式为__________;
②第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的离子方程式为_____________。
第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出。
③第四步,将第三步所得混合物经________(填操作名称)、________(填写 “水”或“乙醇”)洗涤,得到纯净的Na2S2O4晶体。
(4)装置C的作用是 _______________。
Ⅱ.探究Na2S2O4的稳定性
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外层电子数是Y和Z两元素原子最外层电子数的总和;Y元素原子的最外层电子数是它的电子层数的2倍,X和Z可以形成XZ3化合物。请回答:
(1)X、Y、Z的名称分别是___、___、___;
(2)XZ3的分子式__,电子式___;
(3)X、Y的最高价含氧酸的分子式分别为___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L—1NaOH溶液滴定20mL0.l mol·L—1H2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是

A. a点所得溶液中c(H2A)+c(A2—)+c(HA—)=0.1 mol·L—1
B. b点所得溶液中:c(H2A)+2c(H+)=c(A2—)+2c(OH—)
C. 对应溶液的电导率:a<b<c<d
D. 对应溶液水的电离程度:a>b>c>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向 2 L密闭容器中加入1 mol NO(g)和1 mol活性炭(C),发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
温度/℃ | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
下列说法不正确的是( )
A.上述信息可推知:t1<t2
B.t1℃ 时,该反应的平衡常数K=![]()
C.t2℃ 时,若反应达平衡后再缩小容器的容积,c(N2)∶c(NO)不变
D.t1℃ 时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)![]() xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)

A.P3>P4,y轴表示C的转化率
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室根据反应:TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无氧无水条件下制备TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76℃、136℃,且两者互溶)。下列说法不正确的是( )
TiCl4(g)+CO2(g),在无氧无水条件下制备TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76℃、136℃,且两者互溶)。下列说法不正确的是( )

A.③中反应完成后,先停止通N2,再停止加热
B.①、⑤装置中分别盛有无水氯化钙、浓硫酸
C.②中热水使CCl4气化,④中冰水使TiCl4冷凝
D.④中分离TiCl4、CCl4混合物的方法是蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com