
【题目】实验室根据反应:TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无氧无水条件下制备TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76℃、136℃,且两者互溶)。下列说法不正确的是( )
TiCl4(g)+CO2(g),在无氧无水条件下制备TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76℃、136℃,且两者互溶)。下列说法不正确的是( )

A.③中反应完成后,先停止通N2,再停止加热
B.①、⑤装置中分别盛有无水氯化钙、浓硫酸
C.②中热水使CCl4气化,④中冰水使TiCl4冷凝
D.④中分离TiCl4、CCl4混合物的方法是蒸馏
科目:高中化学 来源: 题型:
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是

A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 常见气态氢化物的稳定性:X<Y<Z
C. 1 mol WM溶于足量水中完全反应,共转移2 mol电子
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离提纯(括号内的物质为杂质)的方法错误的是( )
A.乙醇(水)--加入CaO蒸馏
B.NaCl(KNO3)--结晶和重结晶
C.乙酸乙酯(乙醇、乙酸)--饱和碳酸钠溶液,分液
D.己烷(己烯)--溴水,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素 X、Y、Z、W 的相对位置如表,元素 X 的原子核外电子数是 Z的 2 倍。下列说法不正确的是
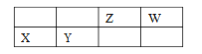
A. W 元素的简单气态氢化物的热稳定性比 Z 元素的简 单气态氢化物的高
B. 气体分子(ZW)2 的结构式为 N≡C—C≡N
C. X、Y、W 三种元素的简单离子半径最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其单质制备可用电解熔融 XCl2 的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读体检报告呈现的的部分内容,判断下列说法不正确的是
项目名称 | 检查结果 | 单位 | 参考范围 |
钾 | 4.1 | mmol/L | 3.5~5.5 |
钙 | 2.15 | mmol/L | 2.13~2.70 |
胱抑素C | 0.78 | mg/L | 0.59~1.03 |
尿素 | 4.18 | mmol/L | 2.78~7.14 |
甘油三酯 | 1.50 | mmol/L | 0.45~1.70 |
A.体检指标均以物质的量浓度表示
B.表中所示的检查项目均正常
C.尿素是蛋白质的代谢产物
D.甘油三酯的结构可表示为![]() (R1、R2、R3为烃基)
(R1、R2、R3为烃基)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如图所示,其中不正确的是

A.步骤④⑤是为了富集溴
B.步骤③说明溴具有挥发性
C.步骤④的离子方程式为Br2+SO2+H2O![]() 2H++2Br-+SO32-
2H++2Br-+SO32-
D.步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
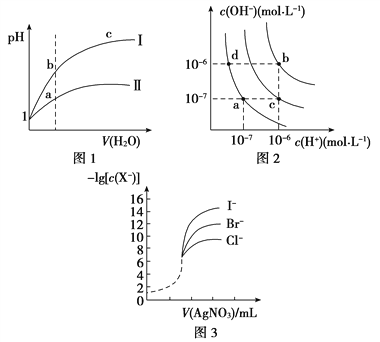
A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中纯水仅升高温度,就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)______________________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为H1、H2、H3,则H1、H2、H3的大小关系为________________________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 | 起始温度 | 终止温度 | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.4 | 20.6 | 23.6 |
4 | 20.1 | 20.3 | 26.9 |
依据该学生的实验数据计算,该实验测得的中和热H_____(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是(_______)
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com